日本橫濱國立大學的信田尚毅副教授、跡部真人教授、東京大學的橫川大輔副教授、須田佳代特任研究員組成的研究團隊,與北海道大學的研究團隊合作,成功開發出了一種能通過電化學激活鹵素原子與路易斯鹼之間滷鍵的相互作用,實現質子與電子協同遷移的新型分子觸媒。這一成果不僅實現了電化學催化下N保護氨基聯苯的分子內C-N鍵形成反應,還成功對觸媒的性能進行了定量評估。這類觸媒的相互作用可通過電化學氧化實現活化,催化分子與受質、鹼形成化合物。實驗與理論計算證實,該化合物通過實現質子與電子的協同遷移,大幅提升了反應速度與化學選擇性。此項研究為迄今尚未確立統一設計指南的電化學催化領域提供了全新的設計思路。相關研究成果已發表在《Journal of the American Chemical Society》上。
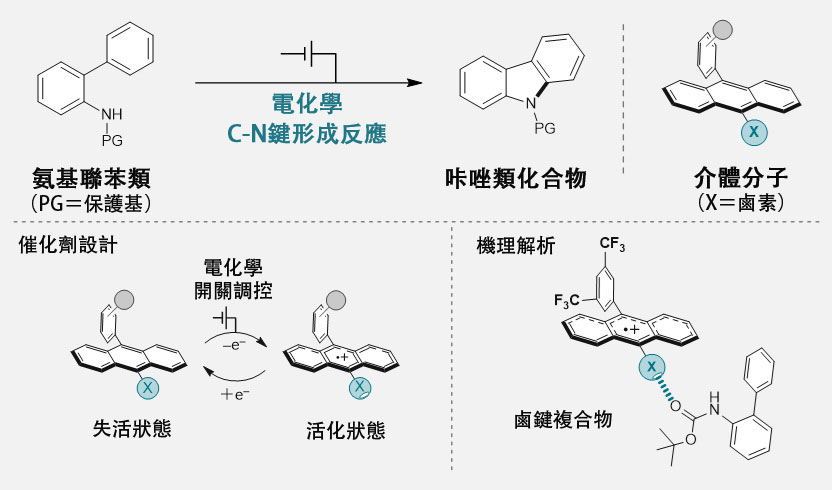
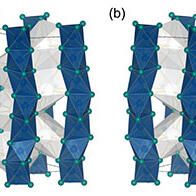
圖1. 本次研發的觸媒及其用於C-N鍵形成反應的示意圖(供圖:橫濱國立大學)
當前,利用電化學的分子轉化技術備受關注,但直接在電極上進行分子轉化的電解反應,面臨需要過高能量(過量電壓)以及電極劣化等問題。作為解決這些難題的手段,一種被稱為「介體」的催化分子正受到關注。介體分子通過在電極與目標反應分子之間充當電子遷移的媒介,不僅有助於解決上述問題,還能大幅提升化學反應的選擇性與效率。然而,目前尚未建立明確的設計指南來指示何種分子適合作為介體使用。
此次研究團隊成功開發出了一種具備電化學開關型相互作用的新型介體分子。尤為關鍵的是,研究團隊首次實現了將電化學活化的滷鍵相互作用應用於有機反應,這將為開發多樣化的觸媒分子和推動電化學發展作出貢獻。在該反應中,首先通過在電極上將介體分子進行單電子氧化,將其轉化為電子缺失狀態,從而激活滷鍵相互作用。隨後,氨基聯苯類化合物與活化後的介體分子相互作用,形成滷鍵化合物。該化合物的形成驅動了質子與電子的協同遷移,促使反應進行,最終在分子內形成芳香環與碳-氮鍵之間的新化學鍵。
此外,研究團隊通過在介體分子中引入蒽骨架,使原本不穩定的單電子氧化態得以穩定化,從而實現了催化性的碳—氮鍵形成反應。基於此策略,研究團隊利用多種含不同鹵素的介體分子,成功以四種帶有不同保護基的氨基聯苯類化合物為受質,高產率地合成了咔唑類化合物。
此外,研究團隊結合理論計算與電化學測量,對反應機構進行了詳細解析。結果表明,滷鍵化合物具有穩定性,證實了相互作用的真實存在。此外還發現,化合物的形成使得體系能夠利用弱鹼,以能量上極為有利的方式驅動質子與電子的協同遷移。
本次研究確立的「具備電化學可切換相互作用的介體設計」,有望通過降低電化學過程的過量電壓、抑制電極劣化,為實現更節能、更可持續的分子轉化作出貢獻。今後,研究團隊將繼續推進能夠精確控制滷鍵強度與電子狀態的分子設計,以進一步提升反應速度與選擇性,並擴大受質的適用範圍。此外,應用範圍也將不侷限於碳-氮鍵形成,研究團隊正考慮將其拓展至碳-碳鍵形成等其他重要成鍵反應。同時,研究團隊還將結合理論計算與電化學測量,推進反應機構的普適性研究,從而系統化介體設計指南,並將其拓展至醫藥品與功能性材料的合成流程中。
原文:《科學新聞》
翻譯:JST客觀日本編輯部
【論文資訊】
期刊:Journal of the American Chemical Society
論文:Redox-Switchable Halogen Bonding in Haloanthracene Mediators Enables Efficient Electrocatalytic C-N Coupling
DOI:10.1021/jacs.5c18175