東京大學研究生院理學系研究科的黑田真也教授、該研究科附屬基因實驗設施的守田啟悟助教等人的研究團隊與新潟大學、奈良尖端科學技術大學院大學、九州大學生體防禦醫學研究所、慶應義塾大學尖端生命科學研究所展開聯合研究稱,利用小鼠揭示了引發肥胖的病理現象。研究發現,小鼠肝臟的飢餓適應能力在結構上對肥胖具有穩健性,但在時間上卻表現出脆弱性。該發現將有助於理解肥胖和糖尿病等的病理機制並促進治療方法的開發。相關研究成果已發表在國際學術期刊《Science Signaling》的4月22日刊上。
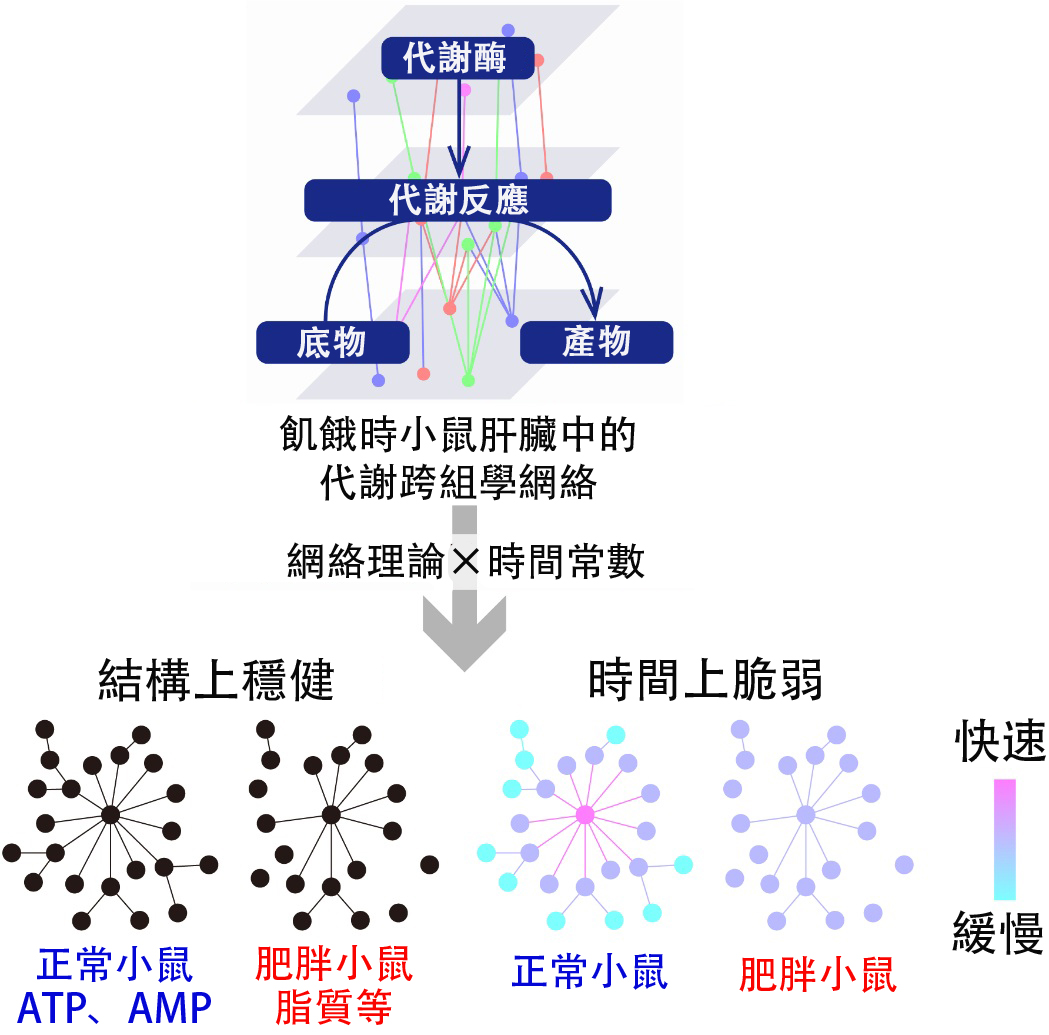
圖1:飢餓時小鼠肝臟中的代謝跨組學網路在結構上穩健但在時間上脆弱(供圖:東京大學)
飢餓時,生物體需要按時間順序調動大量分子,以維持進食前的代謝體內平衡。然而,關於實現這些調控的設計原理以及肥胖引起的病理變化,此前並不十分了解。
為此,研究團隊聚焦於作為代謝中心的肝臟,對正常小鼠和肥胖模型小鼠(欠缺食慾抑制激素瘦素的小鼠)在飢餓狀態下的肝臟進行了水溶性代謝物(糖類和氨基酸等)、脂質、遊離脂肪酸/醯基肉鹼/醯基輔酶A、轉錄組、蛋白質和蛋白質磷酸化的全面檢測,並提取了顯著變化的分子。
研究團隊利用數據庫確定了所提取分子調控的代謝反應,並通過將它們相互連接,構建了小鼠肝臟在飢餓時的代謝跨組學網路。
此外,為整理難以分析的龐大數據,研究團隊採用網路理論和時間常數(應答速率的指標)進行分析,從而對該網路進行了解析。
結果顯示,正常小鼠肝臟中形成了以ATP和AMP等能量相關代謝物為中心的無標度樣網路(由少數樞紐和大量末端組成的網路)。而在肥胖模型小鼠中,儘管ATP和AMP被脂質等取代,但仍保持了無標度樣網絡式結構。這表明網絡式結構對肥胖具有穩健性。
另一方面,通過時間常數解析發現,該網路對肥胖表現出脆弱性。在正常肝臟中,ATP及其代謝物AMP等位於網路中心的分子響應更為迅速,使肝醣分解、糖異生(由氨基酸等代謝物合成葡萄糖的代謝反應)和脂肪酸分解能夠有序地響應。而肥胖模型小鼠則失去了這種秩序,顯示出對肥胖的脆弱性。
黑田教授表示:「近年來,生物學領域也能獲得大量數據。但是,將這些數據不僅僅是用於單純的篩選,作為系統來理解也並非易事。此次通過將基礎網路理論與生物學相結合,我們成功地從系統層面捕捉到了對生物生存至關重要的飢餓適應機制。」
原文:《科學新聞》
翻譯:JST客觀日本編輯部
【論文資訊】
期刊:Science Signaling
論文:Structural robustness and temporal vulnerability of the starvation-responsive metabolic network in healthy and obese mouse liver
DOI:10.1126/scisignal.ads2547