接上篇 【人物】跨越生物化學和細胞生物學的科學家——水島升(上)
探索神秘而複雜的生命世界
現代社會,人類可以享受比較豐盛的飲食,但生物的歷史也是一場與飢餓的鬥爭史。有一個廣為流傳的說法,我們只要有水,就可以生存一個星期。這和一種叫做自噬的機制有關,該機制將我們自身細胞組織中的蛋白質分解成我們需要的氨基酸,而氨基酸是生物體的生命所必需的。據估計,成年人的人體每天產生200-300克蛋白質,其中包括從飲食中攝取約60-80克蛋白質。飲食攝入量和身體產生的蛋白質之間的差異(後者大約是前者的2.5倍)來自哪裏?這個過程中的一個關鍵因素正是自噬。自噬將細胞中的蛋白質分解成氨基酸,然後再次用於製造新的蛋白質和獲取能量。為了試圖理解支撐生命現象的能量和物質的無形流動,換句話說,為了以可見的方式瞭解新陳代謝,就需要挑戰去 「觀測」這些分子。通過捕捉細胞生存方式的動態方法來了解為什麼會有自噬的現象發生。
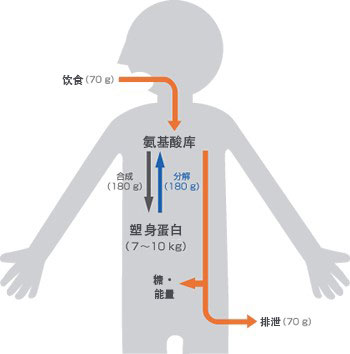
圖2 成人每天的蛋白質代謝情況
自噬現象在上世紀60年代僅通過電子顯微鏡確定,但其生理意義和所涉及的分子群長期以來一直不為人所知。然而,在上世紀80年代末,大隅良典教授和他的同仁證實,出芽酵母也有自噬功能,研究進展迅速。 酵母的遺傳分析已經很先進,迄今已發現近20個自噬相關基因。 有趣的是,它們中的大多數也存在於高等植物和動物中,包括哺乳動物。 對這些基因產生的蛋白質進行分析,發現了一組定位在參與自噬的膜上的蛋白質,如封存膜和自噬體。水島等人在生物實驗過程中重視觀察,但是有時候先入為主的觀念反而會阻礙發現真相,所以他們在觀察時不抱有先入為主的想法,而是首先集中精力研究比較對象之間的差異,並且慎重地擷取其中的資訊。
當時水島的研究既關注自噬的分子機制,也關注自噬在體內的作用,雙管齊下進行深入研究。為了便於觀察,他們使用了綠色螢光蛋白(Green Fluorescent Protein, GFP),這是一種約29kDa的蛋白質,吸收藍光並發出綠色螢光(這種蛋白質是2008年諾貝爾化學獎得主 下村修教授 在1962年發現的)。綠色螢光蛋白附著在這些蛋白分子上,用螢光顯微鏡成功地觀察到其培養細胞體內的自噬現象。將細胞轉移到無營養的培養基中使其處於飢餓狀態,在短短半小時或一小時内,就可以觀察到自噬現象發生,一個細胞内大概有100或200個自噬體。
為了進一步做研究,水島之後在小鼠身上做了與培養細胞完全相同的實驗。他製作了轉基因小鼠,同樣用綠色螢光蛋白使自噬細胞發光。這樣一來就可以一目瞭然地觀察到自噬發生在身體的什麼地方,以及什麼時候發生。在利用小鼠的試驗中發現,其幼崽從出生後到被餵食為止,細胞處於飢餓狀態。為了維持身體所需的氨基酸濃度,會發生自噬。如果小鼠不能自噬,它們會在出生後半天内死亡。此外,哺乳動物的卵子受精並在體內著床也需要大約一個星期。在這段時間裏,卵子必須在沒有任何外部營養支持的情況下繼續發育,自噬也參與了這個過程。儲存在卵子的蛋白質被分解,氨基酸被再利用。也就是說,對於細胞來說選擇是非常簡單明快的事:如果沒有來自外部的營養,它們決定從自己的細胞内部獲取營養。另外還有一件趣事,水島製作的轉基因小鼠非常受歡迎,據悉已被分發給世界各地的500多個實驗室,涵蓋了除了南極洲以外的四大洲的實驗室,堪稱「征服四大洲」。
細胞是由生物大分子組成的,如脂質和碳水化合物,但其中最豐富和最重要的是蛋白質。此外,細胞還包含一些胞器,如含有DNA的細胞核、產生能量的粒線體和負責分泌蛋白質的內質網。這些蛋白質和胞器會隨著時間的推移而變老,還有些蛋白質甚至在合成過程中失敗,就像垃圾一樣散落在在細胞中。如果不清理這些垃圾,細胞就會變得骯髒。在實驗過程中,通過觀察無法在其神經組織中進行自噬的小鼠,發現異常蛋白質在神經組織中的積累可導致疾病。
細胞的自我清潔的能力則被稱為自噬。當胞器和不再在細胞中發揮作用的蛋白質積累時,在細胞中就會形成一種叫做「封存膜」的膜。 這些膜延伸並包裹著碎片,形成一個球形的形狀,稱為自噬體。 然後自噬體與溶體融合,後者含有分解胞器、蛋白質和其他物質的酶,以清理細胞。 裏面的胞器和蛋白質被分解並作為細胞内的營養物質重覆使用。
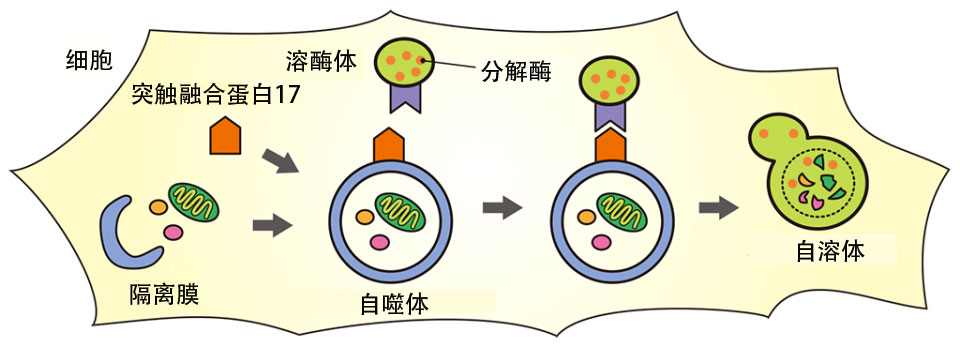
圖3 自噬如何分解細胞内的物質
出典: lne.st/2016/01/28/mizushima-noboru/
唯有熱愛,才能堅持研究
溶體將降解酶帶到自噬體。 當它們附著在自噬體上時,它們尋找的是什麼? 事實證明,溶體不會附著在那些正在吞嚥垃圾、尚未閉口的溶體上,而只會附著在已經閉口、成為完美球體的自噬體上。2012年,水島升發現溶體如何識別自噬體。 顯然,一種叫做突觸融合蛋白(Syntaxin)17的蛋白質可以作為一個標記。 當自噬體球體完成後,突觸融合蛋白17被轉移到自噬體的膜上。 現在已經知道溶體可能會識別這一點。突觸融合蛋白17通常存在於細胞膜和其他胞器中,但人們認為它在自噬體形成後立即被轉移到自噬體中。那麼,突觸融合蛋白17如何知道自噬體已經完成--封存膜上的洞已經關閉,細胞已經變成球形的呢?這正是水島所關注的問題。
在2013年,首個具有自噬基因異常的人類疾病被發現了。 這種名為「SENDA」的疾病從出生開始就會導致智力運動障礙,直到20歲左右症狀不會有太大的變化,到了30歲左右會突然惡化為類似巴金森氏症的症狀,導致患者臥牀不起。 水島在與橫濱市立大學的才津智準教授和松本直通教授以及群馬大學的村松一洋助教(當時的職稱)等人合作進行的研究發現,該疾病與自噬的一個基因異常有關聯。 當他們從這些細胞中抽取血細胞時,發現它們的自噬活性降低了。 這是人類的首例自噬基因疾病。根據海外的研究團隊的研究,發現細胞中被更換的不僅僅是蛋白質,還有粒線體,它是細胞中的胞器。粒線體通常會釋放活性氧(ROS),有一點點活性氧是好的,但如果它們開始釋放大量的活性氧,就會變得危險,所以危險的、受損的粒線體需要從細胞中消失。事實證明,自噬也在其中發揮了作用。需要注意的是,粒線體自噬所需的基因是Parkin和PINK1,而這兩個基因是家族性巴金森氏症的致病基因。因此,研究者認為Parkin和PINK1的突變可能使這些危險的粒線體不受控制,對神經元和其他細胞造成損害。 這種機制可能是造成巴金森氏症的部分原因,並且擁有大量產生活性氧的粒線體不僅對神經細胞死亡很重要,而且對癌症的發病等也很重要。

水島升教授(照片出自東大新聞線上網,攝影:一柳裏樹)
現在大家已經知道巴金森氏症、阿茲海默症和其他與大腦有關的疾病也是由神經細胞中的異常蛋白質堆積引起的,所以從理論上來說,自噬也可能會防止這些疾病的發生。對飢餓的反應是生物體內一個非常基本的機制,但直到二十多年前,在很大程度上並不為人知。 自噬本身在大約六十多年前就已被發現,但在大隅教授發現相關基因和能使自噬體發光的蛋白質之前,幾乎沒有辦法研究這一機制。在隨後的十多年年裏,許多事情被逐漸闡明。水島得以在2004年發現Atg缺陷的小鼠,在2006年發現異常蛋白的降解和純化,在2008年發現在受精中的作用,都離不開眾多研究者們努力探索出來的研究成果。當被問及對研究的看法時,水島說:「自從我是一名醫科學生以來,我一直對在整個身體內發揮作用的東西(例如新陳代謝)感興趣,而不是對某個特定的器官。當時我在醫學院學習到酶和其他物質在體內進行生物合成,但沒有人能闡明這些材料來自哪裏,為什麼合成的產品最後會消失。因為抱有興趣卻毫無頭緒而言,所以我選擇了直接進入臨床工作,研究免疫學。我重視基礎研究。雖然在研究中發現的一些東西可能對治療疾病有用,但我做這項研究的主要動機是為了更好地瞭解生物。」
正是因為有千千萬萬像水島一樣的科學家,懷著對生物的探索之心,通過瞭解神秘而複雜的生命世界,人類最終才有可能治癒疾病。在此預祝水島教授帶領的研究團隊在今後的工作中取得更大的成就。
供稿:馬佳宥
編輯修改:JST客觀日本編輯部
【參考資料】
東京大學研究生院醫學系研究科分子生物學領域水島研究室
武藏高等學校中學校——畢業生暢談學習的土壤:水島升專訪
公益財團法人TERUMO生命科學振興財團——生命科學DOKIDOKI研究室:水島升專訪
東京大學教授水島升 / 什麼是自噬(細胞吞噬作用)?
JST新聞2014年1月號 揭開隱藏在生命中的分解的秘密
東大新聞線上——水島升教授訪談













