東京慈惠會醫科大學腎臟與高血壓內科的松井賢治助教、橫尾隆教授、山中修一郎助教等組成的研究團隊宣佈,通過將人工誘導程式性細胞死亡技術應用於動物模型,成功開發出了選擇性清除器官形成初期的前驅細胞再現慢性腎臟病(CKD)病態的腎功能不全模型小鼠。這一成果有望為解明CKD的發病機理及開發新療法做出貢獻。相關研究成果已發表在國際學術期刊《Nature Communications》的3月15日刊上。
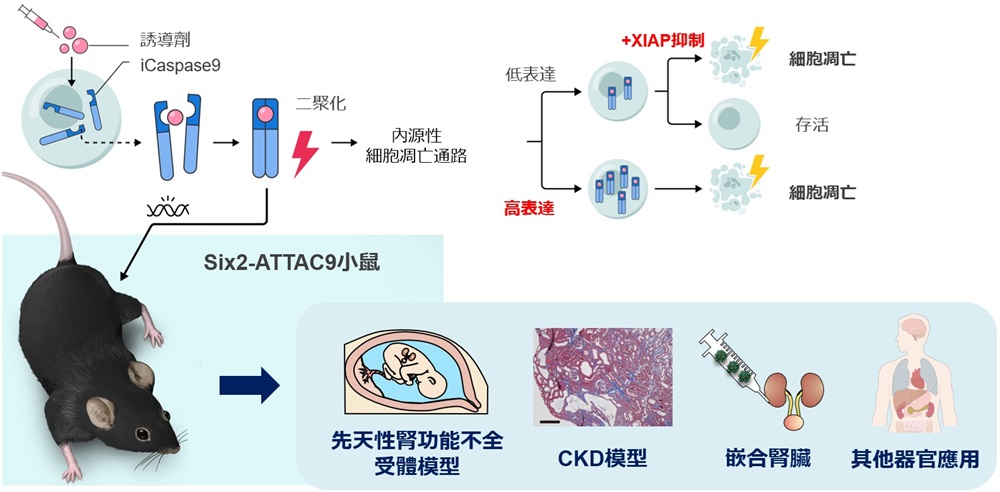
圖1 研究概要(供圖:東京慈惠會醫科大學)
CKD是一類隨著病情加重需要透析或腎移植的疾病,日本國內據估計有1330萬名患者。此前,從胎兒期發病的腎功能不全模型小鼠製作尤為困難,成為研究的一大難題。此次,研究團隊成功開發出了將人工誘導細胞死亡系統「誘導型Caspase9(iCaspase9)」導入小鼠體內的Six2-ATTAC9小鼠。
具體而言,本次研究聚焦於內源性程式性細胞死亡通路的主要執行因子Caspase9,通過導入能與人工合成誘導劑結合的iCaspase9,成功實現了隨誘導劑施用激活程式性細胞死亡通路、選擇性誘導Six2陽性腎單位前驅細胞凋亡的目標。腎單位是負責過濾血液生成尿液的功能性結構,腎臟疾病中該結構會遭到破壞。
誘導劑施用後,iCaspase9發生二聚合化並激活,Six2陽性腎單位前驅細胞被清除。該系統運作需要較高的iCaspase9表達水平,但通過聯合使用具有程式性細胞死亡抑制作用的XIAP抑制劑,即使在iCaspase9表達較低的細胞或實體器官狀態等程式性細胞死亡抗性較高的情況下,仍能引發程式性細胞死亡。
與既往細胞清除方法相比,該技術在速度和去除率等方面表現優異,通過向妊娠母體施用誘導劑,成功使胎鼠腎單位前驅細胞數量減少並誘發腎功能不全。
通過延遲誘導劑的施用時間可使腎功能不全程度減輕,實現對腎功能不全嚴重程度的調控。在妊娠第13.5天施用誘導劑的胎鼠出生後仍能存活,可對慢性腎功能障礙進行詳細觀察。該小鼠表現出與人類CKD患者相同的腎小球腫大及硬化、間質纖維化、發炎細胞浸潤等特徵,將成為解明CKD進展機制的有用模型。
此外,研究團隊從該胎鼠腎臟中去除腎單位前驅細胞,並注入人iPS細胞來源的前驅細胞,從而成功製備了整合人腎組織的嵌合腎臟。
研究還首次在動物模型中證實,相較於細胞離散狀態,實體器官表現出更強的程式性細胞死亡抗性。
山中助教表示:「在按照身體設計圖構建器官時,僅去除特定細胞曾被視為極難實現的任務。此次我們成功為目標細胞嵌入了‘主動消失’的特殊開關,並使其發揮作用。藉此可隨意減少腎臟重要部件(腎單位)的數量,使在實驗室中詳細研究病灶腎臟成為可能。期待這項技術能為未來腎臟疾病治療及新腎臟構建研究(如再生醫療等)提供幫助。」
原文:《科學新聞》
翻譯:JST客觀日本編輯部
【論文資訊】
期刊:Nature Communications
論文:Caspase 9-induced apoptosis enables efficient fetal cell ablation and disease modeling
DOI:10.1038/s41467-025-57795-6