作為新一代醫藥產品而備受關注的中分子藥,在癌症及疑難病症治療等領域蘊藏著巨大潛力。這類藥物能像小分子藥物一樣進入體內細胞,與特定靶點結合發揮作用,然而,要測量究竟有多少藥物能進入細胞、這些藥物能在細胞內停留多久,目前只有既耗時又費力的複雜方法,且無法使用病灶細胞進行驗證。
日本九州大學研究生院理學研究院的川井隆之副教授等人的研究團隊,開發出一種利用水的滲透壓瞬間使細胞破裂,並快速提取細胞內成分的新方法「CyTOR」。該方法僅需簡單操作,就能在短短5秒內提取出細胞內的藥物,並藉助液相層析圖-質譜聯用分析(LC-MS)實現精準測定。研究團隊實際向細胞中加入4種藥物後檢測發現,該藥物在細胞滲透性和排出性上存在差異,且差異與以往研究結論一致。該方法將成為推動藥物研發高效開展的新型細胞膜滲透性測試法,相關研究成果已發表在期刊《Analytical Chemistry》上。
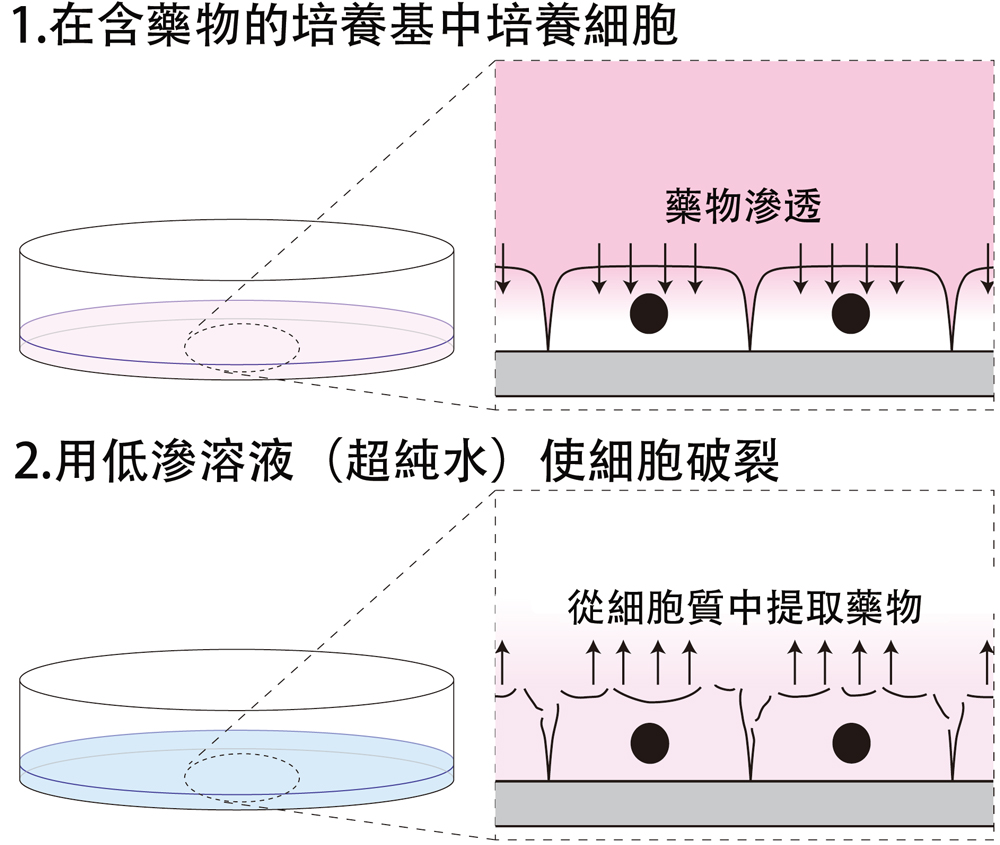
圖1.此次開發的CyTOR法概念圖。(1)在含藥物的培養基中培養細胞一定時間;(2)去除外部藥物,添加超純水使細胞破裂並回收細胞質。提取液隨後進行LC-MS分析,計算細胞內藥物濃度(供圖:九州大學)
CyTOR的操作極為簡單,只需向培養細胞噴灑低滲壓溶液(超純水)即可。噴灑的低滲壓溶液與細胞內會產生滲透壓差,使細胞在短時間內破裂,從而快速提取細胞質。利用滲透壓差提取細胞質中蛋白質的技術此前雖已被開發出來,但這類技術或會使用界面活性劑,或需進行長時間操作,導致存在於細胞質以外(如細胞膜)的藥物也會被一同溶出。而CyTOR通過30秒的快速提取操作,能選擇性提取細胞質中的藥物,通過與LC-MS相結合,即可實現對細胞內藥物濃度的高精度測定。
為確認能否用超純水使細胞破裂並僅回收細胞質,研究團隊首先用calcein-AM和CellMask這兩種試劑處理細胞,分別對細胞質和細胞膜進行染色。然後,用超純水使細胞破裂後發現,添加超純水後僅5秒,細胞質標誌物消失,而細胞膜標誌物即使過了1分鐘也幾乎無變化。這一結果表明,通過CyTOR可快速且選擇性地回收細胞質。
接著,研究團隊從理論層面預測了向培養基中添加藥物後,細胞內藥物濃度隨時間變化的規律,發現該變化可通過藥物滲透率與時間的函數表達。通過將該函數與實際實驗數據擬合併確定常數,最終可計算出藥物進入細胞的難易程度(從細胞外到細胞內的膜滲透性)及排出細胞的難易程度(從細胞內到細胞外的滲透性)。
藥物的進入與排出細胞的難易程度可分為三種模式:易進易出、難進易出、難進難出。研究團隊分別用含有對應這三種模式的小分子藥物(普萘洛爾、西咪替丁、阿替洛爾)及中分子藥物環孢素A的培養基培養HeLa細胞,在不同培養時間點,對CyTOR提取後藥物進行LC-MS分析。計算出相對於所添加藥物的細胞內滲透透比例(藥物滲透率),並將其對照培養時間作圖,結果顯示:每種藥物進入與排出細胞的難易程度,均與以往研究報告呈現高度一致的傾向,這證明利用癌細胞能夠簡便地測量藥物滲透性。
CyTOR是一項實現了以往難以完成的細胞內藥物快速、高精度定量的革新性技術。研究團隊表示,今後將通過引入細胞體積自動測量技術和多藥物同時分析演算法,推進該方法向高通量、分析自動化方向改進。此外,CyTOR不僅可用於藥物分析,還能應用於細胞內代謝物及化學探針的分析,因此有望為理解生命科學研究領域整體的分子動態提供助力。
川井副教授表示:「細胞膜是分隔細胞內外的屏障,具有允許對細胞有益的物質通過、阻止藥物等異物進入的特性。確認藥物是否真的滲透到了病灶細胞中,這一點極為重要。在本研究中,我們通過利用此前長期被忽視的滲透壓,開發出了能瞬間使細胞破裂、簡便提取細胞內藥物的方法。正因為操作簡單,該方法是任何人都能用的有用方法,因此希望更多人都能加以運用。」
原文:《科學新聞》
翻譯:JST客觀日本編輯部
【論文資訊】
期刊:Analytical Chemistry
論文:Quantifying Cell Membrane Permeability of Small to Mid-Size Drugs Using Quick Osmotic Cytoplasm Extraction
DOI:10.1021/acs.analchem.5c01064