長年苦於原因不明的身體不適和慢性症狀,卻無法獲得醫學上明確診斷而被擱置的患者,也即所謂「診斷難民」並不在少數。在這些患者中,有不少人即使接受全基因組分析發現變異,也因無法理解其意義而無法用於診斷。其背景在於,能夠在分子水平解釋基因變化如何影響蛋白質立體結構和功能的手段目前還非常有限。
東京大學先端科學技術研究中心的石北央教授、熊谷晉一郎教授、齊藤圭亮副教授等,與日本順天堂大學研究生院醫學研究科小兒青春期發育與病態學的村山圭教授、同大學研究生院醫學研究科難治性疾患診斷與治療學/疑難雜症診斷與治療研究中心的岡﨑康司教授、八塚由紀子副教授等人在共同研究中,以一名數十年來始終無法確診、曾在國內外多家醫療機構就診仍被判定為原因不明的患者為對象進行了分析。
全基因組分析結果確定了該患者伴隨氨基酸置換的基因異常。如果能夠掌握該變異基因編碼的蛋白質的立體結構,就能在分子水平推測哪些功能受損,最終以何種方式出現症狀。然而,既往的結構解析方法(X射線晶體結構解析法和冷凍電子顯微鏡法)從樣品製備到結構解析需要耗費大量時間和人力,而且無法保證一定能解析出結構。
為此,研究團隊利用AI結構預測技術迅速推定了變異體的立體結構,揭示了異常可能影響DNA修復相關酶活性關鍵部位的可能性。
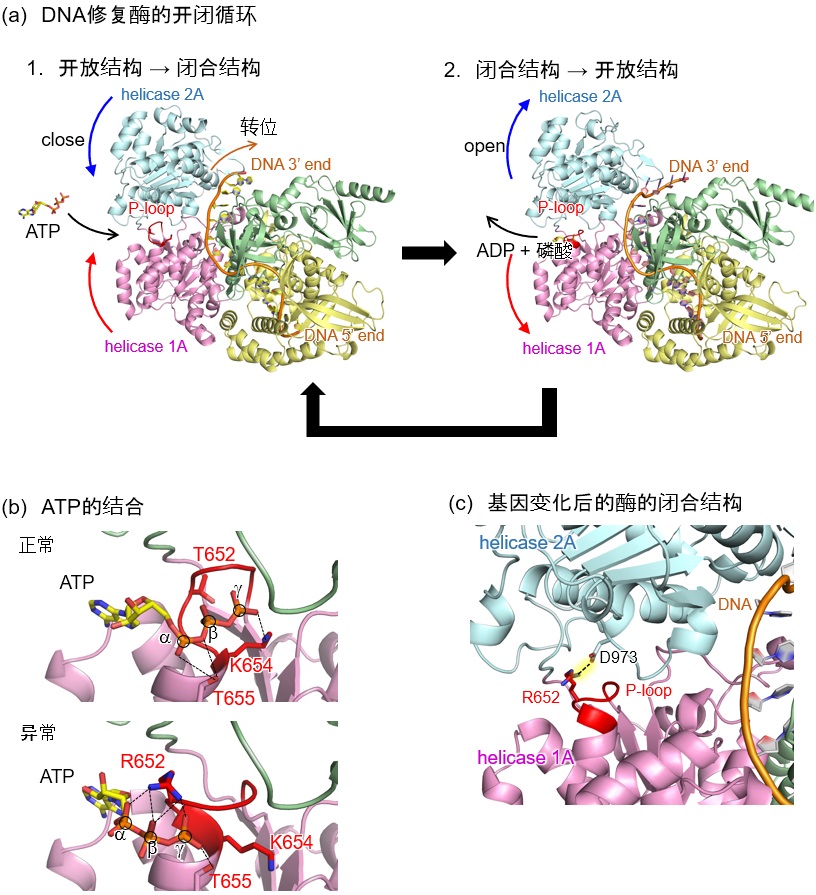
圖1:DNA修復酶的開閉循環與基因變化的影響。ATP結合到結合部位(P-loop)時變成閉合結構並消耗能量,釋放用完的分子(ADP+磷酸)後回到開放結構(a)。本次基因變化引起的氨基酸置換(T652→R652)導致抓住ATP的「手指」(K654, T655)發生偏移(b),原本不應結合的部分意外形成「結合」(R652與D973;虛線),從而導致酶的蓋子保持閉合狀態難以復原(c)。(供圖:東京大學)
DNA修復酶通過結合作為能量來源的ATP來發揮作用。當ATP未結合時,ATP結合部位呈開放結構,當ATP結合後,就變成閉合結構並消耗能量。之後,釋放用完的分子後又恢復為開放結構。通常是以這樣的開閉循環工作的,但本次發現的基因變化導致抓住ATP的手指位置發生微小偏移,原本不應結合的部分之間形成了意外的結合,使得「蓋子」容易陷入保持閉合,難以復原的狀態。結果,ATP的容納和開閉循環發生紊亂,DNA修復所必需的酶活性大幅降低的可能性很高。
通過活用AI預測的立體結構,僅靠傳統的鹼基序列分析無法判斷的結構扭曲與功能下降機制以視覺化和分子科學的方式得以闡明。該成果展示了將基因資訊與蛋白質結構變化相結合、具體解讀病因的實用框架。
由此,研究人員從結構層面開闢出了一條新路徑,可以捕捉隱藏在原因不明症狀背後、看不見的致病原因。隨著整合基因組、結構、分子機制的方法普及,有望加速對未診斷疾病機制的解析與診斷,為「診斷難民」提供有力幫助。
此外,基於蛋白質結構的視覺化獲得的理解,不僅對醫生和研究者,對患者本人來說,能更直觀地瞭解「自己體內究竟發生了什麼」。即使目前尚未確立治療方法,只要分子水平的機制得以明確,患者就能更容易理解自身症狀,可能成為一種心理上的支撐。
相關成果已發表在《Frontiers in Molecular Biosciences》上。
原文:《科學新聞》
翻譯:JST客觀日本編輯部
【論文資訊】
期刊:Frontiers in Molecular Biosciences
論文:A DNA2 Mutation in the ATP-Binding Motif identified in a Diagnostically Unresolved Individual
DOI:10.3389/fmolb.2025.1706392