日本大阪大學產業科學研究所的Martijn Zwama特任副教授(常勤)、西野邦彥教授、藥學部六年級學生櫻井希望、美國聖路易斯華盛頓大學的Yan Yu教授及美國印第安納大學布盧明頓分校的Swagata Bhattacharyya等人,通過運用新開發的兩親性雅努斯奈米顆粒(Janus nanoparticles),成功恢復了多重耐藥革蘭陰性菌對抗菌藥物的藥物敏感性。該成果有望為解決全球性難題——耐藥菌問題提供突破口。相關研究成果已發表在《Nano Letters》上。
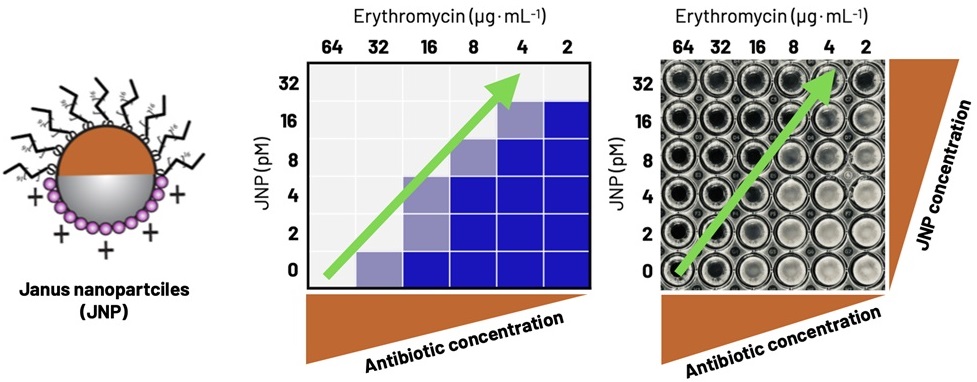
圖1. 左側為具有非對稱結構的雅努斯奈米顆粒(JNP)。中央和右側是分別以示意圖(藍色=存活細胞)和實拍照片(白濁區域=存活細胞)形式顯示的細菌增殖情況,對比了從高到低不同梯度的抗菌藥濃度與JNP濃度組合條件。在不添加JNP的情況下,細菌需在64 µg/mL的抗菌藥濃度下才會被殺死,而添加JNP後,所需的抗菌藥濃度則大幅降低。且JNP濃度越高,殺死細菌所需的抗菌藥濃度就越低(如綠色箭頭所示)。(供圖:Martijn Zwama特任副教授,大阪大學)
全球範圍內,對抗生素產生抗藥性的細菌感染病例數量正在不斷增加,以鮑曼不動桿菌(Acinetobacter baumannii)和大腸桿菌為代表的革蘭氏陰性菌(Gram-negative bacteria),因其擁有堅固的外膜和多藥外排系統,導致藥物難以起效,已成為極其嚴重的威脅。這些細菌中的多數已對多種抗生素表現出抗藥性,部分菌株甚至對目前臨床上幾乎所有可用藥物都獲得了抗藥性。由於抗藥性是由抗生素靶點的突變、抗菌藥物的分解與修飾、膜滲透性的改變以及主動將藥物排出細胞外的外排泵過度表達等機制導致,因此,以往常用抗菌藥物的療效正迅速減弱。
為了維持現有抗菌藥物的有效性,亟需開發能夠與抗菌藥物聯用,恢復其對耐藥菌殺菌效果的新型佐劑。
研究團隊開發了一種由疏水性半球和多價陽離子性半球構成、具有獨特雙面性(兩親性)結構的雅努斯奈米顆粒。該設計旨在通過與細菌膜相互作用以削弱其結構,從而增強多種抗菌藥物類別的活性。
雅努斯奈米顆粒能夠附著在革蘭氏陰性菌的細胞膜上,使其膜結構發生變形,從而增強聯合使用的抗菌藥物的攝取和活性。在極低濃度下,雅努斯奈米顆粒本身並不能單獨殺死細菌,但與抗菌藥物聯用時會產生協同效果。
具體而言,研究團隊確認了雅努斯奈米顆粒與多種抗菌藥物之間存在強協同效應,這些藥物包括紅黴素、新生黴素、利福平、卡那黴素、溴化乙錠和氯唑西林等。根據抗菌藥物種類的不同,在多種細菌中對必要抗菌藥物濃度的降低效果可達100倍以上。此外,由於具有對稱結構的奈米粒子並未表現出類似的協同效應,這表明雅努斯奈米顆粒的非對稱是實現抗菌藥物功能的關鍵。
此外,研究團隊還全新開發了一種可嵌入瓊脂凝膠的雅努斯奈米顆粒系統。該系統能確保與具有運動性的大腸桿菌等細菌有效接觸,即使像β-內醯胺類等起效較慢的抗菌藥物也能實現持續的增效作用。該成果為抗菌塗層、創傷敷料等臨床應用領域提供了新的可能性。
本研究提出了一種不依賴於遺傳學和生物化學靶向、基於材料化學的新型抗菌藥物增效策略。由於雅努斯奈米顆粒通過與細菌膜進行物理相互作用來發揮功能,因此細菌難以對其產生抗藥性,並能與多種現有抗菌藥物產生協同效應,將其作為佐劑聯合使用,可有效延長現有藥物的臨床使用壽命。此外,嵌入雅努斯奈米顆粒的瓊脂凝膠有望拓展至抗菌塗層、藥物遞送系統等新領域,為抑制多重耐藥菌感染開闢了創新的臨床應用前景。
西野教授表示:「本研究是在材料化學與微生物學融合的國際聯合研究推動下,實證了單一學科領域無法達成的新型創新成果。多重耐藥菌感染在全球範圍內日益嚴峻,已成為醫療現場的緊迫難題。本次研究所展示的兩親性雅努斯型奈米顆粒,是一種能夠恢復現有抗生素療效的新策略,且因其不易引發抗藥性,我們相信這是一項具有重大社會影響力的技術。期待該成果能為今後的耐藥菌防控提供新的助力。」
原文:《科學新聞》
翻譯:JST客觀日本編輯部
【論文資訊】
期刊:Nano Letters
論文:Amphiphilic Janus Nanoparticles Synergize with Antibiotics to Restore Susceptibility in Drug-Resistant Gram-Negative Bacteria
DOI:10.1021/acs.nanolett.5c05337