2025年12月25日,日本東海大學醫學部的龜谷美惠客座副教授等人的研究團隊宣佈,成功開發出可再現個體化人類免疫反應的下一代「免疫人源化小鼠」模型。該模型通過使用體內持續產生IL-4(白血球介素4)的小鼠,實現了人類B細胞的長期維持,並成功在其表面產生高功能的人源IgG抗體。同時在小鼠體內(脾臟)確認形成了與人類淋巴組織相似的結構。該成果有望應用於抗體藥物候學選物評估及癌症疫苗評價研究。相關研究成果已發表在《Frontiers in Immunology》的2025年11月26日刊上。
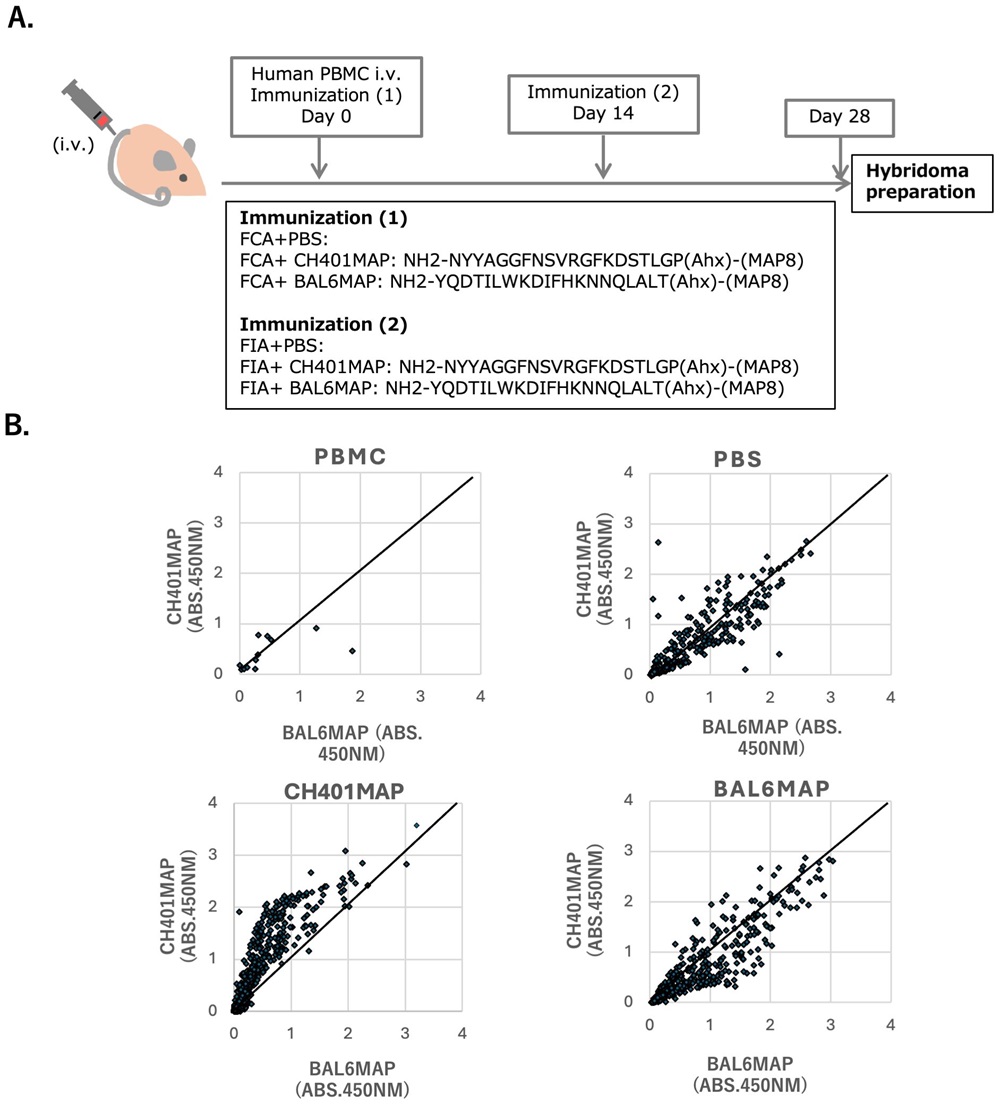
圖1 分泌IgG抗體的B細胞融合瘤製備流程(供圖:東海大學)
隨著免疫檢查點抑制劑和癌症疫苗等利用人類免疫反應的治療方式不斷擴展,人們對能夠在治療的前更準確再現個體化人類抗體應答的前臨床動物模型的需求也日益增加。
然而,既往使用的免疫缺陷小鼠模型中人類B細胞存活動時間短,難以對誘導產生抗體特異性IgG的效果進行有效評估。
人類B細胞是一種能夠識別病原體、產生抗體以保護機體的淋巴細胞,約佔血液成分的5%~10%。特異性IgG是免疫球蛋白的一種,可對特定抗原產生反應,其被分為五類(IgM、IgD、IgG、IgA、IgE),其中IgG主要承擔排除病原菌的功能,並廣泛應用於臨床免疫治療等領域,被認為是實用性最高的抗體類型。
本次研究團隊將人類外周血單個核細胞(PBMC)移植至全身表達人源IL-4的轉基因NOG小鼠體內,探索了重建個體化人類免疫系統的可能性。IL-4由活化T細胞、肥大細胞及巨噬細胞產生,承擔信號傳導功能並調控抗體生成。
既往研究已證實,採用外周血中的免疫細胞進行PBMC移植的人源化小鼠模型,會因小鼠體內僅有人類T細胞被快速激活並增殖,從而引發移植物抗寄主病(GVHD)並導致小鼠死亡。
另一方面,本次構建的人源化小鼠模型憑藉血漿中維持在100-1000pg/mL範圍的有限IL-4濃度,成功實現了人類B細胞的存活與增殖,顯著延遲了GVHD的發生,並促進了抗體類別向IgG的轉換。免疫球蛋白最初以IgM形式產生,在受到刺激後會在保持變異區不變的情況下,通過類別轉換將恆定區轉化為IgG或IgA。
此外,研究團隊確認了移植後4周時B細胞的高定植率。移植後產生IgG的B細胞選殖數量增加,且隨著時間的推移,IgG亞類的構成變化呈現出與人類相似的變化趨勢。
研究還證實,產生的IgG選殖其變異區存在大量氨基酸替換,並發生了對抗原識別至關重要的體細胞超突變(SHM)。
在採用HER2(人表皮成長因子接受者2)來源肽段(如CH401MAP與BAL6MAP)進行免疫的個體中,獲得了多個能夠對這些肽段產生反應的人源IgG選殖。研究團隊同時還證實,還可以製備出用於量產單源抗體的人源B細胞融合瘤。
此外,研究團隊還在脾臟中觀察到由人類B細胞和T細胞構成的三次淋巴組織樣結構(TLS)。TLS被認為是在局部發揮免疫調控中樞作用的結構。儘管本次觀察到的TLS尚不屬於完全形態,但被認為可能支持免疫應答以及有限的免疫成熟。
利用本次開發的小鼠模型,可以評估患者等供體所攜帶的B細胞能夠產生何種抗體。
研究團隊表示,未來將致力於闡明支持人類B細胞長期存活的環境因數,同時開發更高效構建高特異性人源抗體生產融合瘤的技術方法。
龜谷客座副教授表示:「在人源化小鼠模型中,NOG-hIL-4-Tg起初並未受到重視,但我們通過持續研究,逐步確立了其作為重建個體適應力免疫系統模式的價值,如今終於發表了具有說服力的研究成果。今後計畫通過進一步改良,持續提升該模型的抗體產生能力。」
原文:《科學新聞》
翻譯:JST客觀日本編輯部
【論文資訊】
期刊:Frontiers in Immunology
論文:IL-4 dependent enhancement of human IgG production in PBL-NOG-hIL-4-Tg mice
DOI:10.3389/fimmu.2025.1670682