
野田展生
微生物化學研究所結構生物學研究部部長
2013年入選CREST研究代表
(2013~2019年、2020年~)
由聯合研究走進不同領域
潛心於自噬現象的闡明
自噬是回收體內蛋白質的循壞系統,它並不會分解一切,它將要分解的物質包裹到名為「自噬體」的脂質膜結構中之後進行分解(圖1)。也就是說,自噬體在包裹物質時會區分要分解的物質和不分解的物質。日本微生物化學研究所結構生物學研究部的野田展生部長的研究正在專注於這種自噬體的形成機制。野田還擔任CREST「細胞内現象的空間時間動態」研究領域的「多級高階結構群驅動的自噬動態」研究的研究代表。
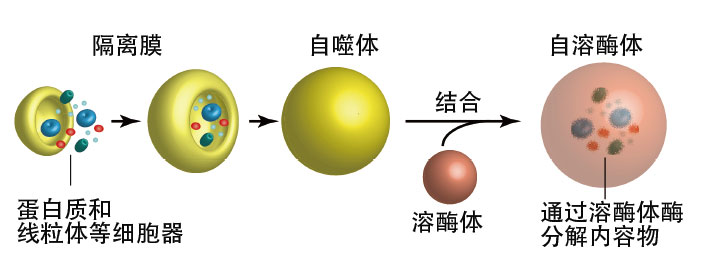
圖1:進行自噬時,首先脂質會在細胞中聚整合膜,形成包裹蛋白質和粒線體等胞器的「自噬體」。自噬體與含有自噬分解酶的「溶體」結合,通過這種酶分解被包裹在内部的胞器等。自噬生成的氨基酸在體內被回收用於抵禦飢餓,自噬還可以分解淨化進入細胞的細菌和導致功能不良的胞器等。
野田和自噬的相遇要回溯到博士後時期。博士生時代他的專業X射線晶體結構分析,通過向蛋白質晶體照射X射線調查其構造。取得博士學位後,野田到北海道大學研究生院藥學研究科的稻垣冬彥教授(當時)的研究室做了博士後研究員,稻垣教授的研究室當時正在推進在不形成晶體的情況下通過核磁共振(NMR)分析蛋白質結構的研究。
野田回憶當時的情況說:「我想通過分析蛋白質的結構瞭解生命現象。但即使通過晶體知道了蛋白質的結構,當它在體內或發生反應過程中,結構也可能發生變化,因此我感覺到結構與生命現象之間還存在很大的距離。所以開始苦惱是否應該這樣研究下去,所以決定學習一種能觀察更接近實際生命現象的動態狀態的方法」。就在野田開始感嘆利用NMR在溶液狀態下分析蛋白質結構的方法時,稻垣研究室收到了東京工業大學的大隅良典特任教授提出的聯合研究邀請。
大隅博士發現過很多與自噬有關的ATG基因,為闡明這些基因的功能,大隅博士邀請稻垣一起開展聯合研究。野田在聯合研究中負責調查ATG基因產生的Atg蛋白的結構。野田回憶說:「說來慚愧,直到開始進行聯合研究,我都不知道自噬是什麼。匆忙學習後發現這是一個非常有趣的現象,一下子就著了迷」。當時科學界雖然已經知道自噬與胞器和蛋白質的分解及再生有關,但其機制幾乎完全未知。此外,還涉及到很多基因,所以我覺得這是一個值得研究的生命現象。
搬運形成自噬體材料的蛋白質
内部是巨大的疎水性空腔
野田就這樣開始了他的自噬的研究。氨基酸以鏈狀合成的蛋白質具有由序列決定的固有空間結構,這種結構決定了功能。為明確當時幾乎完全不瞭解的Atg蛋白的結構和功能,野田製作了Atg蛋白的晶體,試著分析了結構。很多Atg蛋白除了呈特定空間結構的區域外,還同時擁有無穩定結構、會不斷變化的「固有無序區域」,所以很難結晶。野田通過去除固有無序區域成功製作了晶體,並接連確定了結構。
最後剩下的一個挑戰是,Atg蛋白中體積最大的Atg2和唯一的膜蛋白Atg9。研究發現,Atg2會與脂質結合蛋白Atg18形成復合體,並與作為自噬體前驅物的隔離膜結合。然後在2017年利用電子顯微鏡分析發現,Atg2呈棒狀,長約20奈米(奈米為10億分之1米)。野田成功地使其部分結晶,2019年分析其結構證實,它的中心存在巨大的空腔。
這個空腔内部幾乎全部由疎水性氨基酸構成,因此野田認為它會與脂質結合。於是嘗試讓空腔與磷脂的復合體進行結晶,結果野田的推測完全成立,磷脂結晶在空腔中。這表明,Atg2是負責從內質網提取形成自噬體所需的磷脂,並將其轉運至自噬體的脂質轉運蛋白(圖2)。
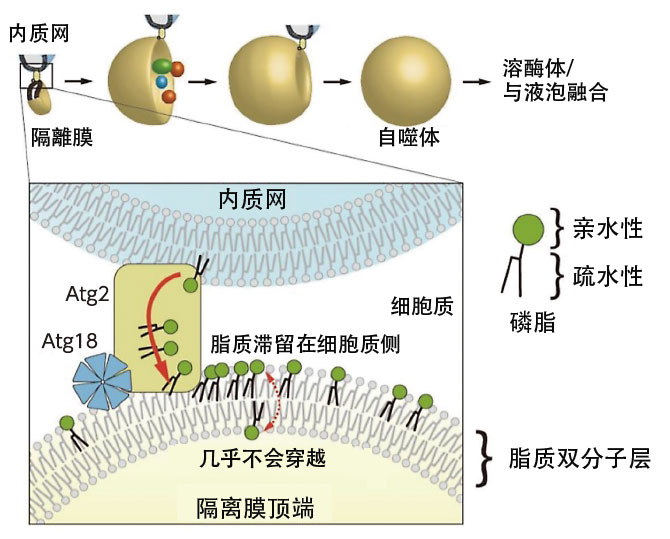
圖2:自噬體形成過程模式圖。誘導自噬時,細胞質中會突然出現名為隔離膜的膜結構。隔離膜邊包裹分解對象邊伸展,最後關閉形成自噬體。隔離膜伸展所需的磷脂由Atg2從內質網供應,但光這樣的話,脂質會堆積在隔離膜的細胞質層中,膜不會伸展。
另一方面,自噬體是由脂質雙層膜構成的囊狀器官。即使Atg2運來雙層膜細胞質側外層的磷脂,如果沒有內層的脂質,也無法伸展雙層膜。因此,野田著眼於作用未知的膜蛋白Atg9。為調查Atg9的結構,努力對其進行了結晶,但在很長一段時間裏始終無法得到晶體。後來通過與參與CREST同一領域研究的東京大學研究生院醫學系研究科的吉川雅英教授開展的聯合研究取得了突破。利用吉川教授的專業冷凍電子顯微鏡確定了Atg9的空間結構。由此發現,Atg9與Atg2一樣,也有疎水性空腔,野田認為Atg9可能具有轉運脂質的功能。
野田利用體外的人工脂質膜證實了Atg9的功能,結果顯示,Atg9具有在外層和內層之間轉運脂質的功能(圖3)。另外還證實,使形成含脂質的空腔的氨基酸發生突變後,酵母無法形成自噬體。野田說:「通過研究發現Atg2與Atg9相互協作形成自噬體。對於這種完全出乎意料的機制感到非常驚訝」(圖4)。
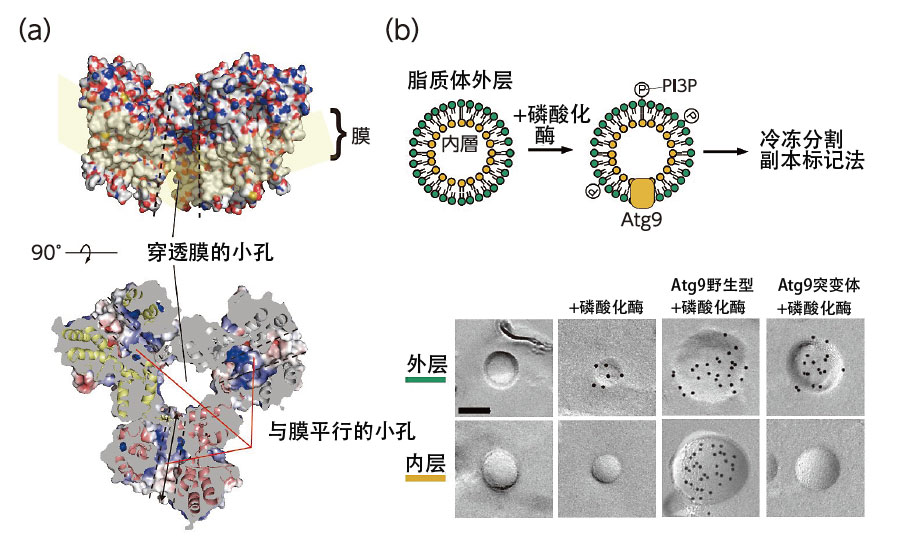
圖3:Atg9的結構與脂質加擾活性。Atg9形成三聚物,中心存在穿透膜的小孔,各個分子中存在與膜平行的小孔(a)。這些小孔相連,形成了脂質的通道。Atg9具有將微脂體外層的PI3P(一種磷脂)移動到內層的活性,但這種活性可以通過小孔的突變體抑制。黑點表示PI3P的分佈(b)。
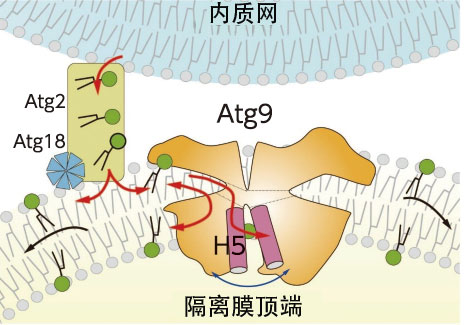
圖4:通過Atg2和Atg9形成自噬體的脂質雙層膜的情況。Atg2連接內質網膜和隔離膜,將內質網膜中所含的磷脂轉運到隔離膜的細胞質層。Atg9與Atg2和Atg18一起局部存在於隔離膜頂端,通過將Atg2轉運的磷脂移動到另一側的層中,來實現隔離膜的伸展。
逆向思維成轉機
通過相分離表達功能
野田多年來一直致力於從蛋白質的結構中瞭解其功能,但當他看到為了發表論文而轉列的模式圖時,他意識到了蛋白質可能是通過固有無序區域聚集,從而表達其功能。野田說:「我一直想通過結構分析來明確蛋白質的功能,所以多年來始終忽略了礙事的固有無序區域。但後來,我換了一種想法,發現正是我認為礙事的區域對蛋白質發揮作用很重要」。調查發現,2009年德國的研究團隊報告了特定的蛋白質在細胞内分離成與周圍不同的液相並濃縮的「液-液相分離」的概念,之後,關於固有無序區域參與「液-液相分離」的報告接連出現。
在過去的研究中,大隅博士也發現,處於飢餓狀態的酵母在形成自噬體前,Atg蛋白收歛集到一處,雖然功能未知,但大隅博士將其命名為「前自噬體結構(PAS)」。由於「液-液相分離」形成的液滴與PAS相似,因此野田決定通過「液-液相分離」的概念重新調查Atg蛋白。
出席會議結識聯合研究人員
利用新分析方法取得成果
野田首先決定調查Atg蛋白是在什麼狀態下工作的。在觀察其在細胞質中的狀態時,以顯微鏡觀察為主,而不是結構分析。雖然引入了螢光顯微鏡,但研究室裏沒有顯微鏡方面的專家。經過幾天的反複試錯,好不容易獲得了基礎數據。
通過數據可以確認,Atg13在營養豐富時與磷酸結合併分散開來,在暴露於營養缺乏的環境中時會脫磷酸作用,並聚集在液泡膜旁邊,勉強維繫周圍的蛋白質,同時形成PAS(圖5)。野田發現,這樣形成的PAS會融合變成球形等,表現出液體的性質(圖6a)。但是需要獲得更準確的動態資訊來證明這一點,所以考慮與顯微鏡專家進行聯合研究。
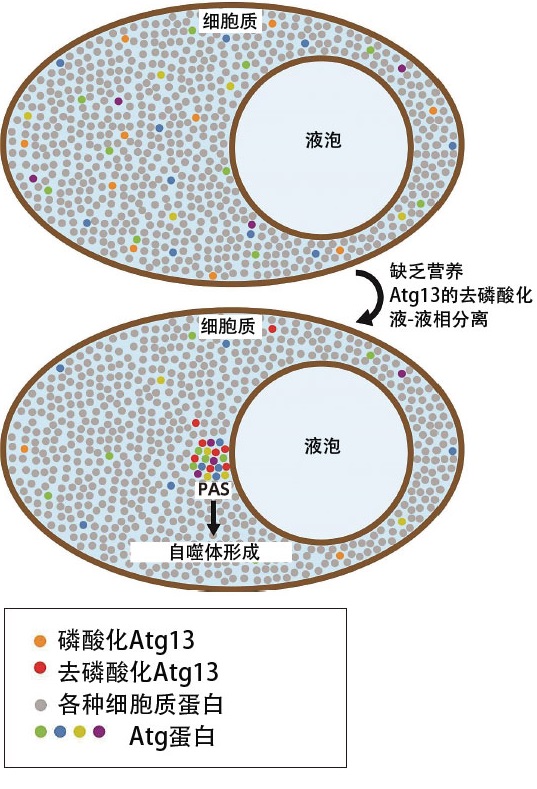
圖5:「液-液相分離」形成PAS的模式圖。在營養豐富的條件下,Atg蛋白分散在細胞質中,與充滿細胞質的各種蛋白質混合。當缺乏營養,Atg13脫磷酸作用時,Atg13會與其他Atg蛋白一起進行「液-液相分離」,在液泡膜上形成新的液相(液滴)。這些液滴就是PAS的喻體,自噬體通過液滴形成。
與顯微鏡專家的邂逅是在JST主辦的與其他研究團隊進行交流的學習會上。野田說:「擁有最尖端生物成像技術的東京大學研究生院理學系研究科的岡田康志教授跟我說他對自噬感興趣。從那時起,我們就一直在進行聯合研究。」
在與岡田教授的聯合研究中,利用螢光顯微鏡調查了細胞質中呈線狀結構的Atg13的運動。由此證明,Atg13即使是在PAS内部時,也具有毫不遜色於在細胞質中時的運動性,也就是說,PAS是具有液體性質的液滴。
為了更詳細地觀察PAS内的Atg蛋白,野田還向在CREST的研究領域會議上結識的金澤大學奈米生命化學研究所的安藤敏夫特任教授提出了聯合研究請求。野田說,他前往開發出高速原子力顯微鏡(高速AFM),擁有直接觀察蛋白質動態的技術的安藤那裏時,又結識了另一個人。他強調說:「我非常幸運,曾在安藤研究室做博士後的能代大輔正尋找下一個職位時,就邀請他來了我的研究室。正是因為他的到來,我們現在可以在研究室進行高速AFM觀察。能操作最新設備的人才真的很重要。」
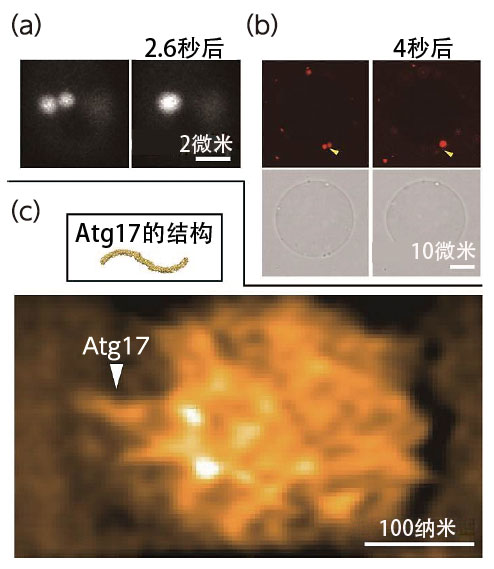
圖6:利用螢光顯微鏡和高速AFM拍攝的液滴(PAS)圖像。PAS在酵母細胞内融合變成球形的樣子(a)。通過與Atg13融合的螢光蛋白的螢光觀察。Atg蛋白液滴在巨大的微脂體膜上融合的樣子(b)。上面兩張圖片是Atg13的螢光圖像,下面兩張是微分干涉圖像。高速原子力顯微鏡下的Atg蛋白液滴觀察結果(c)。可以看出,與Atg13一起促進液滴形成的S字型Atg17以隨機方向存在於液滴中。圖像進行了FFT帶通濾波處理。
野田在試管内重建PAS並用顯微鏡觀察到了與細胞内相同的相互融合現象(圖6a、b)。接下來利用高速AFM觀察重建的PAS,發現在PAS内部Atg蛋白以保持特徵性結構不變的狀態隨機移動(圖6c)。通過這種方式,野田在聯合研究中利用最新的分析方法確定,Atg蛋白聚集進行「液-液相分離」形成的液滴是PAS的真實面目,「液-液相分離」直接控制自噬。
研究室内也進行跨領域融合
年輕研究人員帶來新活力
野田發現的「液-液相分離」直接控制自噬的現象表明,之前一直偏重部分領域進行研究的「液-液相分離」其實與各種生命現象都有關。他就今後的研究計劃表示:「‘液-液相分離’是一個非常有趣的現象。我們希望利用此前的發現,著手研究更高級的生命現象,比如睡眠和病毒感染等」。(研究中)通過加入「液-液相分離」的視角,為闡明此前未知的現象帶來了希望。
研究室中的人才的多樣性也是支持野田擴大研究的重要因素。據野田介紹,每次有新成員加入時,都會盡量避免專業領域重合,研究室裏每天都在以跨領域融合的方式推進研究。野田說:「在這裏,每個人都是各自領域的唯一專家。不僅能學習新知識,還可以發揮自己的經驗,大家都幹勁十足地投入到研究中。希望年輕的研究人員在不同領域進行積極嘗試。」
隨著引進新的分析方法和設備,研究迅速取得進展的情況並不少見。在各自的專業領域積累了經驗和知識的年輕研究人員能為研究室帶來新的活力,並可能催生出重要的研究成果。我們期待新一代自噬研究人員能跨越國界大展身手。
文:JSTnews 11月號
翻譯編輯:JST客觀日本編輯部
【相關閱讀】
【自噬開創的新世界】(一)60年研究歷程,現狀與未來
【人物】跨越生物化學和細胞生物學的科學家——水島升(上)
【人物】跨越生物化學和細胞生物學的科學家——水島升(下)














