廣島大學自然科學研究支援開發中心的宮岡裕樹副教授與該校研究生院先進理工系科學研究科的市川貴之教授等人組成的研究團隊宣佈,成功開發出了利用氫化鋰(LiH)常壓合成氨的有效控制技術。該技術著眼於鋰的高氮解離能,通過不同於現有貴金屬催化工藝的多級化學反應,成功地在常壓狀態下合成了氨。由於可以利用小規模設備合成,有望成為利用氫能實現去碳社會的新型儲氫法。相關成果已經發布在國際科學期刊《The Journal of Physical Chemistry C》的2月2日號上。
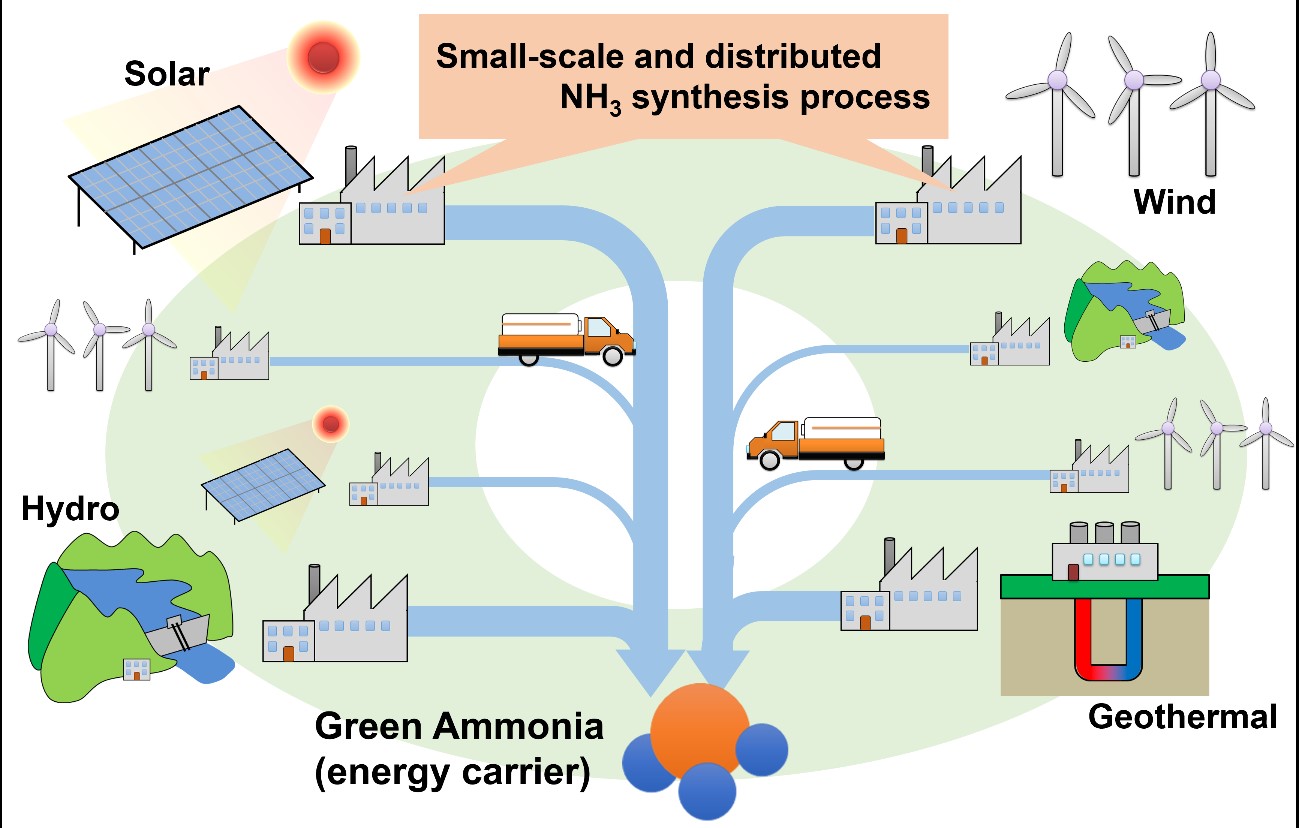
小規模分散型NH3的合成(圖片由廣島大學宮岡裕樹副教授提供)
日本政府2020年10月宣佈在2050年之前實現溫室氣體淨零排放的碳中和。2021年4月發表的第6次能源基本計劃著眼於碳中和時代,將氫定位為新資源之一,計劃推動氨作為氫儲運介質的用途。
氨(NH3)的合成目前大都採用哈柏法,在約500℃和250個大氣壓力以上的高溫高壓條件下進行,適用於大量生產化肥等。這種方法對於利用來自可再生能源這種分佈不均的自然能源製氫而獲得剩餘氫氣儲存和運輸而言成本太高,需要有能在低溫低氣壓條件下可控的小規模分散型NH3合成技術。
研究團隊此前發現,鋰具有很高的氮解離能,並進一步開發和公佈了可在常壓下利用鋰合金合成氨的方法。
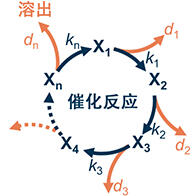
研究團隊此次著眼於鋰的高氮解離能,研究了通過與使用貴金屬觸媒的現有工藝不同的多級化學反應回收LiH,同時合成NH3的化學循環工藝。
首先,為了了解及控制利用氫化鋰(LiH)以下面兩個步驟合成NH3,研究團隊進行了實驗。
反應①氮化反應:4LiH+N2→2Li2NH+H2
反應②NH3合成/再生反應:2Li2NH+4H2→2NH3+4LiH
實驗使用尺寸為數毫米的粉末LiH,在0.1MPa(常壓)的條件下,即使加熱至500℃時的反應率約為60%,保持20小時後也只有約80%。
為調查原因,利用掃描電鏡觀察反應①的反應過程後發現,生成物與未反應的樣本凝聚在一起。所以為了抑制凝聚,考慮添加化學性質穩定的物質作為反應場所,於是在反應①的LiH中混合了Li2O。
隨著Li2O作為反應場所發揮作用,反應速度提高,20分鐘内反應率達到100%。並且確認抑制了凝聚。混合Li2O後,反應②的反應速度也獲得了提升,實現了100%的反應率。在反應②中,加熱到260℃時就開始生成NH3,還確認到再生出了LiH。
該技術通過將氮氣和氫氣獨立導入反應容器可以循環合成NH3,因此能實現小型化。由於是發熱反應,除初期的加熱外,在原理上被認為可以自行反應。
今後將研究包括熱管理在内的反應過程控制,在實際環境中評估特性,並探索成本更低的Li2O替代物質等。該技術已經取得專利,計劃1-2年内確立技術。
宮岡副教授表示:「化學循環技術有一個非常大的優點是,與現有技術不同,無需將氮和氫同時放入容器中。在氮和氫的反應時間不斷切換合成氨作為控制技術而言是一個優點。今後打算在熱管理的同時,研究應該如何控制。」
英文論文 Accelerated ammonia synthesis holds promise for conversion of renewable energy
原文:《科學新聞》
翻譯編輯:JST客觀日本編輯部