BMP2蛋白質具有出色的骨形成作用,在歐美被用於治療難治性骨折及脊柱固定手術,以加速骨骼癒合。由於膠原蛋白是骨骼的主要構成成分,且具有良好的生物相容性,目前主要採用含有BMP2的膠原蛋白海綿(CS),但在移植早期,CS中的BMP2會快速釋放到周圍,引發強烈的發炎反應,甚至可能在非預期部位形成骨骼。大阪大學研究生院醫學系研究科博士生古市拓也和特任副教授海渡貴司、教授岡田誠司等人組成的研究團隊發現,若在骨再生過程中,將奈米黏土凝膠(NC)與促進骨和軟骨形成的蛋白質BMP2混合,幾乎不會引發發炎反應,同時可實現高質量的骨再生。該研究為可安全實現骨癒合的次世代骨再生資料開闢了新的可能。該研究成果已發表在《Bioactive Materials》上。
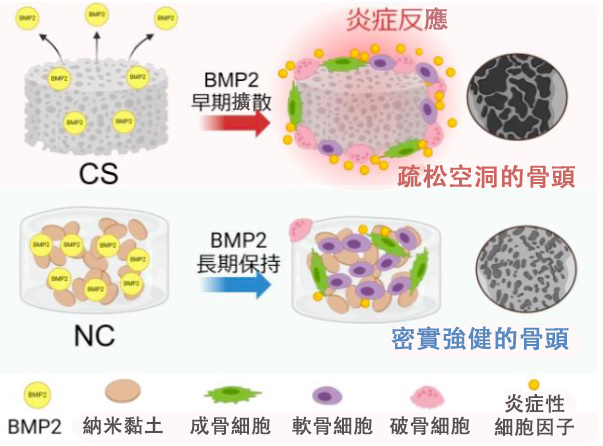
圖1.CS和NC成骨模式示意圖。BMP2在CS中較早釋放,導致強烈的發炎反應。在NC中,幾乎不會產生發炎反應,且内部會形成優質骨骼。(供圖:大阪大學)
研究團隊通過用NC取代CS,與BMP2結合後,NC幾乎不會將BMP2釋放到週遭環境,不僅抑制了BMP2引發的發炎反應,還在預期位置實現了高質量的骨形成,從而驗證了奈米黏土凝膠作為新型骨形木材料的有效性。
首先,研究團隊將混合了NC和BMP2的材料移植到小鼠筋膜下,測試其抑制發炎反應和促進骨形成的效果。使用CS時,隨著BMP2劑量的增加,發炎細胞會在CS外部聚集,形成厚厚的發炎反應層。而當使用NC時,發炎細胞幾乎沒有積聚,只有少量的發炎細胞聚集在NC内部。而且即使增加BMP2的劑量,也未見發炎向周圍組織擴散。
此外,使用CS時,CS的外側會形成非預期的骨質(異位骨化),而新生骨骼内側因充滿脂肪組織則顯得疏鬆。另一方面,使用NC時,在内部形成大量均勻的軟骨後,軟骨會轉化為骨骼,從而形成緻密且堅固的骨骼,且隻在預期部位生長。
在模擬人體脊柱手術的模型實驗(大鼠脊椎骨固定手術)中證實,使用NC可實現骨質緻密堅固的骨癒合。此外,基於細胞的實驗表明,NC本身具有促進細胞分化為軟骨或骨組織的作用(促進分化),並能抑制進行骨吸收的破骨細胞的活動。
古市拓也表示:「人工關節(不癒合)和骨缺損會給患者帶來疼痛和活動限制,治療難度大。BMP2作為一種強效骨再生促進蛋白備受關注,但其副作用風險一直是個問題。該研究的結果表明,BMP2可以有效、安全地使用。我們希望通過這項再生醫學的進展,讓患者的骨骼更快癒合,早日恢復到自由生活狀態。」
原文:《科學新聞》
翻譯:JST客觀日本編輯部
【論文資訊】
期刊:Bioactive Materials
論文:Nanoclay gels attenuate BMP2-associated inflammation and promote chondrogenesis to enhance BMP2-spinal fusion
DOI:doi.org/10.1016/j.bioactmat.2024.10.027