和歌山縣立醫科大學醫學部先端醫學研究所的安藝大輔講師(研究當時隸屬於慶應義塾大學醫學部)與慶應義塾大學、東京理科大學1月17日聯合發表研究成果稱,代謝功能障礙相關脂肪性肝炎(MASH)的肝臟發炎可通過調節性T細胞的增加而受到抑制。對MASH小鼠模型的分析表明,T細胞獨特性核接受者Nr4a家族的基因缺失會顯著增加調節性T細胞,並增強抗炎功能。這一成果將有望推動MASH治療方法的開發。相關研究成果已發表在國際學術期刊《The Journal of Clinical Investigation》上。
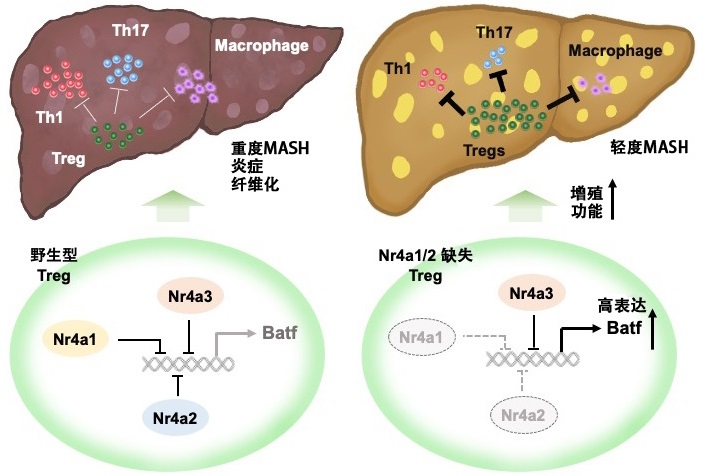
圖1:研究成果概要(供圖:和歌山縣立醫科大學)
MASH(Metabolic dysfunction-Associated Steatohepatitis)是由NASH(非酒精性脂肪性肝炎)更名而來的疾病名稱。主要由非酒精性脂肪肝引起,病情進展可能導致慢性肝炎、肝硬化,甚至發展為肝癌。MASH在全球範圍內呈增長趨勢,在日本約有300萬以上的患者,但目前尚無有效的治療方法。
肝臟中除了主要負責肝功能的肝細胞外,還通過微血管含有包括T細胞在內的各種免疫細胞。隨著肝炎的發展,細胞的死亡引發纖維化,進而激活免疫系統,形成進一步導致細胞死亡的惡性循環。因此,研究人員抑制懷疑免疫細胞與MASH之間存在關聯,但具體機制一直未能明確。
此前,東京理科大學生命醫科學研究所的吉村昭彥教授(研究當時隸屬於慶應義塾大學)等人的研究表明,核接受者Nr4a家族參與了T細胞向調節性T細胞(Treg)和CD8T細胞的分化,並在免疫應答中充當「剎車」角色。核接受者與激素等細胞外物質結合後進入細胞核,並通過與特定基因序列結合來調節基因轉錄。
為了明確T細胞與MASH的關係,此次研究團隊對通過特殊飲食誘導MASH的小鼠模型的肝臟T細胞Nr4a基因表現進行了解析。結果顯示,在CD4T細胞和CD8T細胞中,MASH模型小鼠的Nr4a表達水平比野生型小鼠更高。
Nr4a家族由Nr4a1~3這三種非常相似的分子組成,T細胞中完全缺失這些分子的實驗小鼠會因嚴重的自體免疫疾病而死亡。因此,研究團隊採用了僅缺失Nr4a1和Nr4a2的dKO小鼠進行實驗,並在其體內誘導了MASH。
其結果表明,在dKO小鼠中,MASH常見的肝功能下降、肝細胞死亡、發炎性巨噬細胞浸潤及肝纖維化現象均有所緩解。此外,當僅在CD8T細胞中缺失Nr4a1/2時,並未觀察到MASH的耐性變化,因此推測CD4T細胞中的Nr4a對MASH的發病機製起關鍵作用。
為了進一步闡明機制,研究團隊檢測了肝臟中T細胞的分佈情況,發現在誘導MASH的dKO小鼠肝臟中,促進發炎應答的Th1和Th17細胞減少,而抑制發炎反應的Treg則顯著增加。
此外,研究團隊還分離了野生型小鼠和dKO小鼠的CD4T細胞,並通過單細胞RNA測序進行了分析,結果顯示,僅在dKO小鼠的肝臟CD4T細胞中,具有免疫抑制作用的IL10高表達,並且特定Treg亞群的數量及IL10的表達水平均有所增加。研究團隊還證實,特定Treg亞群的轉錄因子Batf呈高表達狀態,強製表達Nr4a2可抑制Batf的表達。進一步的實驗表明,在dKO小鼠的Treg細胞中抑制Batf的表達會導致細胞增殖減少和IL10下降。
研究團隊計劃今後開發培養和增殖目標調節性T細胞的方法。
安藝講師表示:「基於本次研究結果,我們有兩個重要期待。首先,增加Treg數量可能對MASH的預防和治療具有積極作用。其次,如果能夠在T細胞中適度抑制Nr4a,或者相反提高Batf的表達水平,就有可能促進強效抗炎的Treg細胞擴增。結合這兩種方法,有望開發出以T細胞為靶點的MASH治療方案。」
原文:《科學新聞》
翻譯:JST客觀日本編輯部
【論文資訊】
期刊:The Journal of Clinical Investigation
論文:The Nr4a family regulates intrahepatic Treg proliferation and liver fibrosis in MASLD models
DOI:10.1172/JCI175305