日本大學共同利用機關法人自然科學研究機構生命創成探究中心(ExCELLS)的Christian Ganser特任助教、西口茂孝特任研究員(現任大阪大學研究生院工學研究科特任助教)、名古屋大學研究生院理學研究科的Chan Feng-Yueh研究員、內橋貴之教授(兼任ExCELLS客員教授)組成的研究團隊,全球首次成功開發出了一種能夠在奈米尺度上測量活細菌膜動態力學性質的「高速線上力映射(HS-iFM)」新型顯微鏡技術。該技術成功揭示了大腸桿菌細胞膜的硬度在細胞分裂過程中發生的變化。相關研究成果已發表在《Science Advances》上。
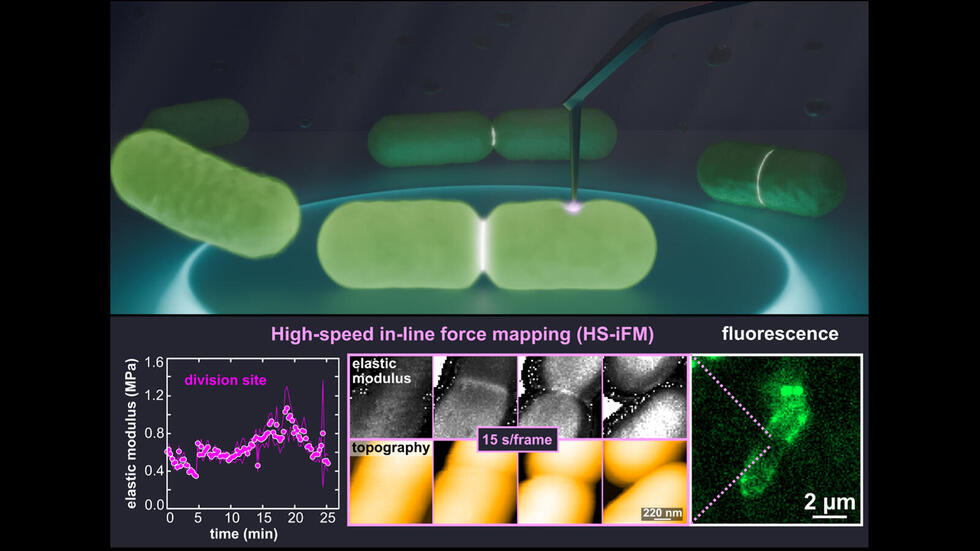
圖1:以高速線上力圖與螢光顯微鏡學成像之大腸桿菌。表面形貌與彈性模數圖之同步成像顯示分裂位點發生硬化。(供圖:名古屋大學)
細胞的硬度被認為會因藥物作用或癌變而發生變化,因此希望開發出能以奈米級解析度測量這些變化的顯微鏡技術。然而,光學顯微鏡觀察微小結構的能力有限,而電子顯微鏡則無法觀察活體生物樣本。另一方面,原子力顯微鏡(AFM)可以高解析度測量物質的力學特性,但既往AFM的成像速度較慢,難以適用於觀察活細胞中發生的動態現象。
研究團隊開發了一種結合了AFM高速化與力學特性測量的HS-iFM技術。該技術使得在分子水平上同時測量活細胞表面形狀和力學特性成為可能。
研究團隊利用HS-iFM技術以大腸桿菌為對象進行了觀察,當細胞分裂進行時,分裂部位的膜明顯比周圍區域更加硬化。這種硬化被認為是由於局部膜張力和細胞壁厚度增加所致。特任助教甘塞爾表示:「通過對活細菌的觀察,可以直接追蹤細胞在生命活動過程中的變化情況。儘管目前對大腸桿菌的研究非常深入,但其在奈米尺度上的動態力學變化仍存在許多未解之謎。」
此外,研究團隊還觀察到,在細胞分裂過程中,連接2個子細胞的膜橋形成並最終斷裂。膜橋的形成和斷裂平均需要242秒,這一過程被觀察到了7次。在分裂的細胞中,研究團隊還觀察到直徑小於100奈米的軟區,軟區的破裂會導致細胞壓力下降和死亡。由於分裂中的細胞尚未完全分離,一個子細胞的破裂還會導致相鄰子細胞的壓力下降。
此外,研究團隊還觀察到正在分裂的大腸桿菌細胞膜上的孔洞的形成、閉合和再形成。這種孔洞被認為與膜小泡(外膜小泡)的形成有關,在分裂過程中,新細胞壁附近的形成頻率會增加。不過,觀察到的孔洞直徑(34.7奈米)大於既往報告的膜蛋白複合體直徑(約8奈米),因此需要進一步的研究來揭示其具體機制。
HS-iFM技術具有推動多種生物樣本研究的潛力。特任助教Ganser表示:「今後,我們希望研究抗生素等外部刺激對活細菌膜奈米力學特性的局部和動態影響。」
研究團隊計劃通過HS-iFM技術,進一步提高速度和解析度,以期未來能夠實現對單個蛋白質等微小分子力學特性的視覺化觀察。
原文:《科學新聞》
翻譯:JST客觀日本編輯部
【論文資訊】
期刊:Science Advances
論文:A look beyond topography: transient phenomena of Escherichia coli cell division captured with high-speed in-line force mapping
DOI:https://doi.org/10.1126/sciadv.ads3010