星藥科大學的大竹史明副教授、森田真衣(碩士生)、高尾美優(本科生)、千葉崚太郎(碩士生)等與鳥取大學的佐藤裕介副教授、德久步乃佳(博士生),東京大學的佐伯泰教授等人聯合發表研究成果稱,發現了細胞內蛋白質分解的博弈新原理。研究團隊揭示了在細胞內泛素連接酶與切割酶在拮抗中實現蛋白質分解的矛盾機制。同時還發現,這些酶的拮抗作用可調控發炎反應。上述發現有望為開發發炎性疾病的新治療方法提供幫助。相關研究成果已發表在國際學術期刊《Nature Communications》的3月24日刊上。
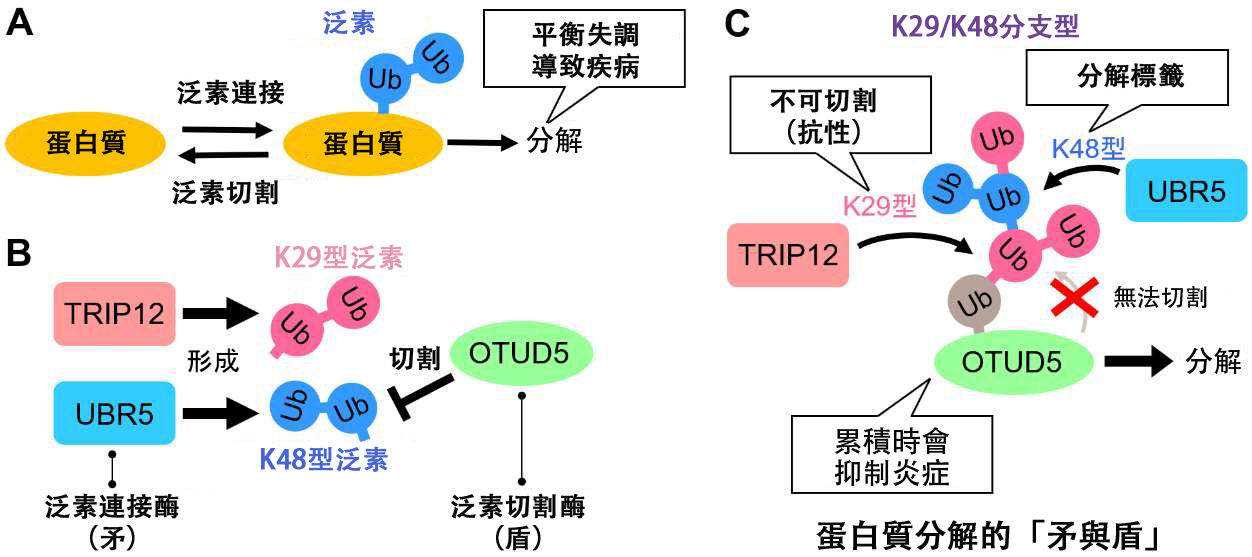
圖1 蛋白質分解的矛與盾(供圖:星藥科大學)
細胞內合成的蛋白質在不需要時會被分解,但如果不能進行合適的分解,將導致不需要的蛋白質在細胞內積累,從而引發癌症或神經退行性等疾病。相反,如果蛋白質被過度分解,細胞就會失落功能,同樣也會成為疾病的原因。
細胞內負責蛋白質分解的主要途徑是泛素—蛋白酶體系統,對於不需要的蛋白質,會添加一種被稱為泛素的標記(蛋白質),然後被泛素標記的蛋白質會被運送到被稱為蛋白酶體的酶複合體中進行分解。細胞主記憶體在許多泛素連接酶與切割酶,二者相互拮抗。此前並不清楚蛋白質是如何在兩種酶在細胞內相互較量的過程中被分解的。
此次研究團隊的研究目標為泛素連接酶TRIP12和UBR5。
添加的泛素會形成泛素間相互連接成鏈狀的泛素鏈,這也是蛋白質分解的標記。
雖然TRIP12形成「K29型」泛素鏈,UBR5形成與之不同的「K48型」泛素鏈,但研究團隊發現了兩者共同的分解目標泛素切斷酶OTUD5。
研究其中的機制發現,OTUD5能夠容易地切斷K48型泛素鏈,因此僅靠UBR5無法促進分解。相反,K29型泛素鏈自身不能單獨作為分解標籤發揮作用,但它對OTUD5具有抗性,能夠避免被切斷。
當TRIP12和UBR5共存時,會形成「K29/K48分支型泛素鏈型」,它既能避免OTUD5的分解,又能作為標籤發揮作用。
此外,OTUD5是由炎性細胞介素引發的發炎反應抑制因子。研究表明,當TRIP12/UBR5的分解控制失效,OTUD5積累時,細胞的發炎響應就會受到抑制。
大竹副教授表示:「本次研究探究了細胞內不再需要的蛋白質被主動分解這一現象的根本機制。從長遠來看,這些發現有望應用於開發出人工分解致病蛋白的‘靶向蛋白質分解藥物’技術」。
原文:《科學新聞》
翻譯:JST客觀日本編輯部
【論文資訊】
期刊:Nature Communications
論文:Combinatorial ubiquitin code degrades deubiquitylation-protected substrates
DOI:10.1038/s41467-025-57873-9