東京大學研究生院工學系研究科的上野博史講師、野地博行教授等人的研究團隊,與千葉大學研究生院理學研究院的村田武士教授、日本大學共同利用機關法人高能加速器研究機構(KEK)物質結構科學研究所的千田俊哉教授、安達成彥特任副教授(研究當時,現任筑波大學生存動力學研究中心副教授)開展合作研究,成功人工改造了可製造生命活動必需物質ATP的「ATP合成酶」,其能量轉換功能高於迄今報告過的其他任何天然酶。通過將通常只有一個的酶內質支控道增加到三個,使改造型ATP合成酶即使在驅動ATP合成的質子驅動力極小的環境下也能合成ATP。相關研究成果已發表在期刊《Nature Communications》上。
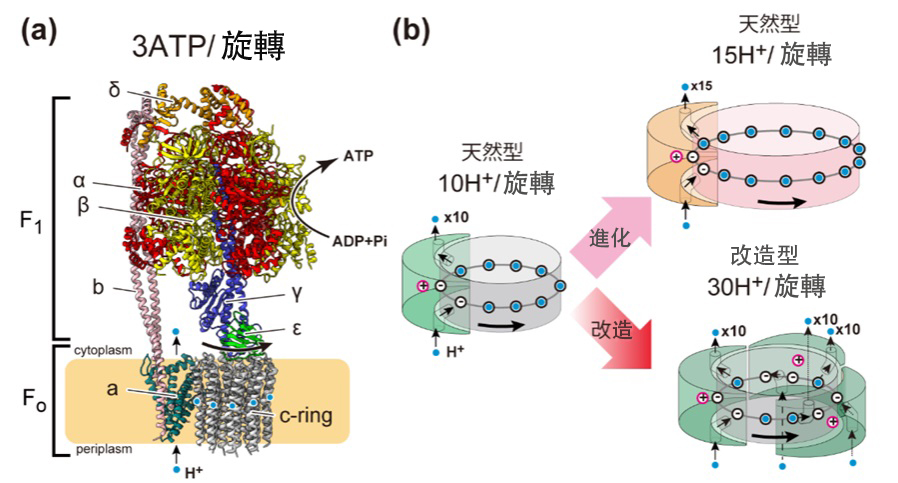
圖1:天然型ATP合成酶的結構(a)以及天然型與改造型Fo馬達的模式圖(b)(供圖:東京大學、出處:文末論文)
ATP也被稱為生物體的能量貨幣,包括人類在內的所有生物都以其作為生命活動的能量源。ATP合成酶是一種由借助細胞膜分隔的內外氫離子濃度差所產生的能量(質子驅動力)隨氫離子流一起轉轉的Fo馬達,以及在ATP水解驅動下旋轉的F1馬達組合而成的複合馬達。當質子驅動力足夠強大時,Fo馬達會驅動F1馬達向與ATP分解時相反的方向旋轉,並利用ADP和磷酸合成ATP。這一機制被類比為水壩回收水流推動渦輪機(水車)的發電過程。
ATP合成酶為製造1分子ATP所需的氫離子數量(氫離子/ATP比)因生物種類而異,大致在2.7~5的範圍內。氫離子/ATP比例越小的酶,每個氫離子所需要的能量就越大,反之,氫離子/ATP比越大的酶,所需的能量就越小。換言之,利用更多氫離子的酶會以「更低的檔位」旋轉,即使在質子驅動力(能量差)較小的狀況下也能合成ATP。這個氫離子的數量,是由ATP合成酶Fo馬達中存在的、能結合氫離子的次單元——c次單元的數量決定的。因此,據稱迄今為止生物是通過根據自身生長環境改造c次單元的數量、調整氫離子/ATP比,不斷進化到了能夠穩定合成ATP。
研究團隊嘗試了顛覆上述常識的新設計。重點研究了ATP合成酶所具有的Fo馬達的質支控道。通常,這種酶中的質子通路(a次單元)只有1條。但研究團隊進行了使其具備多條通路的工學改良。具體而言,團隊設計了一種配備最多3條被稱為「外周柄」(Peripheral stalk)、相當於支撐酶轉子的「臂」的定子結構,且分別擁有獨立質子通路的複合體。其形象如同水流從3個方向衝擊並轉動水車,作用機制是以多條質子流使馬達旋轉,從而即便是以更小的能量也能驅動ATP合成方向的旋轉。
實驗結果發現,改造型ATP合成酶正如團隊預期的那樣,顯示出較高的氫離子/ATP比(5.8,約為改造前野生型的2倍)。這比迄今報導的任何自然界的ATP合成酶的氫離子/ATP比率都要高。此外,實驗證實,該改造型酶即便在極低的質子驅動力下也能合成ATP。
也就是說,即便在傳統酶因「力量不足」而無法合成ATP的狀況下,新型酶卻能通過積累少量能量來生產ATP。研究團隊進一步通過冷凍電子顯微鏡進行單顆粒分析後,得到了具有最多3條質子通路的結構,確認了酶按照設計完成了改造。
這個成果具有劃時代意義,展示了在生命體能量轉換機制方面仍存在設計的空間,同時也是突破生物所具備的分子機械極限的一種全新途徑。未來,有望將相關知識付諸應用,並將其拓展至開發高能量轉換功能的生物、通過人工微生物開發人工光合作用系統等生物工學、生物製造、合成生物學領域。
原文:《科學新聞》
翻譯:JST客觀日本編輯部
【論文資訊】
期刊:Nature Communications
論文:Engineering of ATP synthase for enhancement of proton-to-ATP ratio
DOI:10.1038/s41467-025-61227-w