6月11日,福井大學醫學系部門醫學領域生命資訊醫科學講座藥理學的青木耕史教授等人的研究團隊宣佈,已明確在腸道上皮細胞中特異性發揮作用的轉錄因子CDX1與CDX2會協同抑制大腸癌的惡化。小鼠實驗證實抑制這兩個基因的表達會導致大腸癌的惡化並增加癌症幹細胞特性。該成果有望推動新型的大腸癌治療藥物的開發。相關研究成果已發表在期刊《Cell Death & Disease》的5月21日刊上。
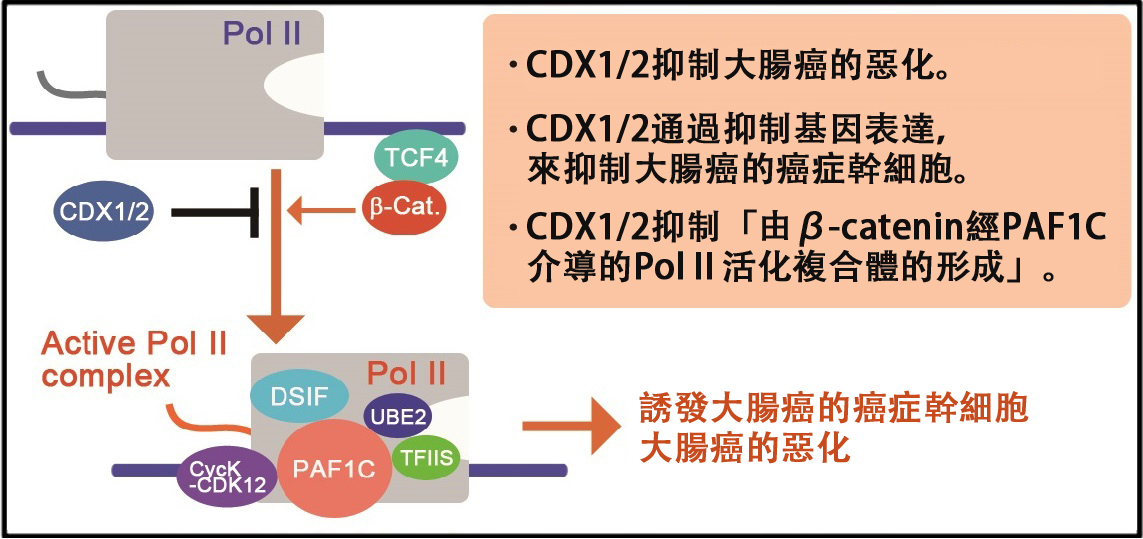
圖1:研究的主要成果。CDX1和CDX2通過β-catenin對PAF1複合體的抑制,來抑制大腸癌的惡化和癌症幹細胞。
根據日本2020年的統計,日本的大腸癌新發病例在各類癌症中人數最多,約達15萬人,每年約有5萬人死亡。
超過80%的大腸癌以APC基因的突變為起點,由面向腸道內腔的黏膜上皮細胞中形成的良性腫瘤(息肉)逐步進展為惡性腫瘤(癌)。APC基因的突變會通過增加β-連環蛋白(β-catenin)的量,誘導產生癌症幹細胞的基因群的表達。
此前,研究團隊已於2024年闡明瞭β-連環蛋白會以PAF1複合體等物質為媒介激活將DNA轉錄為mRNA的酶——RNA聚合酶Ⅱ(RNA polymeraseⅡ),從而誘導癌症幹細胞相關基因群的表達。
此外,有報告指出,特異性地存在於小腸和大腸的上皮細胞中、對其發育和穩定狀態維持不可或缺的轉錄因子CDX1、CDX2可能參與了癌症的惡化過程。但其作用機制尚未探明。
對此,研究團隊調查了CDX1和CDX2對癌症的影響。
研究中使用了在APC基因中引入突變、會在小腸及大腸中形成腫瘤的腫瘤模型小鼠。
首先,當抑制CDX1基因時,小腸中的腫瘤發生了惡化,但大腸中的腫瘤並未惡化。而當同時抑制CDX1和CDX2這兩個基因時,大腸中的腫瘤也發生了惡化。這表明CDX1/2具有抑制大腸癌惡化的作用。
由於CDX1和CDX2是胺基酸序列及靶基因幾乎完全相同的轉錄因子,因此研究團隊推測是基因抑制所導致的表達量減少產生了作用。
為瞭解析這一機制,研究團隊在培養細胞中全面分析了受CDX1基因或CDX2基因控制的基因。
結果表明,這些基因的表達會抑制多個參與癌症幹細胞功能的基因。研究證實,這兩個基因的表達能夠分別降低作為癌症幹細胞標誌物的CD44分子及LGR5基因的表達,並且抑制腫瘤類器官的增殖。
此外,研究團隊通過染色質免疫沉澱測序(ChIP-seq)技術,調查了CDX1/2基因結合的DNA區域。
研究結果明確了上述兩種轉錄因子與深度參與癌症幹細胞特性的LGR5基因的染色體結合。CDX1/2被認為會直接控制癌症幹細胞特性相關基因的表達。
研究團隊還分析了CDX1/2如何參與RNA聚合酶Ⅱ的激活過程。
結果顯示,CDX1/2通過兩種因子的互利共生,抑制了由β-連環蛋白經PAF1複合體介導的RNA聚合酶Ⅱ的激活。
儘管以抑制β-連環蛋白為導向的藥物研發已在全球範圍內進行了約20年,但尚未取得成功。若能找到大腸癌的新靶點,則有望推動藥物研發的進展。
青木教授表示:「在本次研究中,我們瞭解到CDX1和CDX2在RNA聚合酶Ⅱ的激活過程中會發揮了癌細胞抑制作用,但這一基本過程,是與β-連環蛋白,還是與形成PAF1複合體的6種因子中的哪一種相關,目前尚不明確。今後如果能通過分析闡明抑制機制,我認為或許能以此為啟發,為大腸癌的治療藥物開發做出貢獻。」
原文:《科學新聞》
翻譯:JST客觀日本編輯部
【論文資訊】
期刊:Cell Death & Disease
論文:CDX1 and CDX2 suppress colon cancer stemness by inhibiting β-catenin-facilitated formation of the Pol II-DSIF-PAF1C complex
DOI:10.1109/ACCESS.2025.3568510