東京都立大學研究生院理學研究科的廣田耕志教授、侯賽因·MD·巴耶濟德(研究生)、川澄遼太郎助教的研究團隊發表研究成果稱,已揭示出人類細胞抵禦核苷類似物之一的「阿洛夫定」細胞毒性的分子機制。研究發現,參與DNA複製的核酸酶「FEN1」可通過清除進入細胞的阿洛夫定,發揮降低其細胞毒性的作用。該發現有望推動基於新機制的抗癌藥物的開發。相關研究成果已發表在《Nucleic Acids Research》的7月18日刊上。
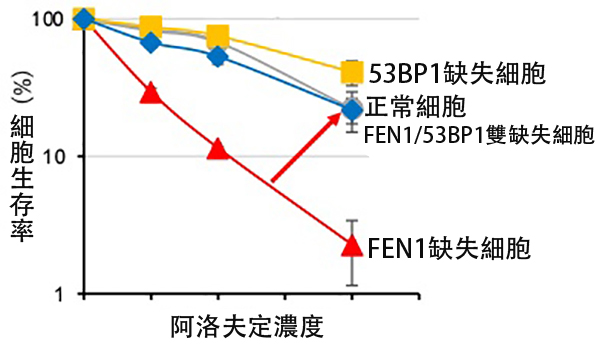
圖1 編碼名為53BP1的DNA修復酶的基因同時缺失時,細胞狀態可恢復至接近正常細胞水平(供圖:東京都立大學)
核苷類似物是一類結構與DNA原料——核苷高度相似的化學物質的總稱,自1980年代起就被用於治療HIV等病毒感染性疾病以及白血病等癌症。因其與DNA原料相似,會在DNA複製過程中被整合到新合成的基因組DNA中,從而抑制複製反應。由於其能夠更強效地抑制複製頻率高且反應準確性低的病毒和癌細胞的複製反應,因此常被用於相關治療。然而,其具體分子機制此前一直未明確。
此前,廣田教授等人一直致力於研究細胞抵禦各類核苷類似物細胞毒性的分子機制。研究發現,不同核苷類似物會呈現完全不同的細胞毒性,且降低其毒性所需的DNA修復因子也各不相同。研究團隊旨在開發出能特異性「精準靶向」癌症中DNA修復因子突變的新一代治療方法。
此次,研究團隊利用24種與DNA修復相關的基因變異體,檢測了阿洛夫定對細胞增殖的抑制程度。
結果表明,在DNA複製反應中負責切割DNA的酶基因——「FEN1(在滯後鏈合成時逐個切割新生鏈末端的flap結構以促進高效連接的酶)」的變異型細胞對阿洛夫定表現出高細胞毒性。此外,在FEN1基因缺失的細胞中,經阿洛夫定處理後的複製速度顯著下降。
另一方面,這種複製速度的減慢在同時缺失編碼DNA修復酶53BP1基因的情況下,可基本恢復至正常細胞水平。研究發現,在FEN1缺失的細胞中,阿洛夫定在DNA複製過程中會異常蓄積在基因組內,進而導致53BP1異常蓄積,最終引發DNA損傷。
去年,研究團隊曾發現,細胞對阿洛夫定毒性的抵抗性與同源性重組反應必需的BRCA基因相關。
為明確其關聯性,研究團隊製備了FEN1與同源性重組同時受損的細胞,對其關聯性展開了研究。
結果顯示,與僅單一功能受損的細胞相比,雙缺失細胞對阿洛夫定的抵抗性大幅下降。這表明,FEN1可獨立於同源性重組機制,發揮抵禦阿洛夫定細胞毒性的作用。
由於FEN1基因突變及表達異常常見於多種癌症,該研究成果有望應用於FEN1基因突變型癌症的治療。
廣田教授表示:「我們發現,用於治療病毒感染性疾病的核苷類似物,不同藥物所需的DNA修復因子各不相同。這一點可稱為癌症的‘阿喀琉斯之踵’(致命弱點),有望為開發針對DNA修復弱點的新型癌症治療方法奠定基礎。本次研究證實,阿洛夫定這類藥物對FEN1修復因子存在異常的癌症具有特殊療效。未來,我們計畫進一步檢測更多藥物的效果,推動核苷類似物成為癌症治療的核心藥物。」
原文:《科學新聞》
翻譯:JST客觀日本編輯部
【論文資訊】
期刊:Nucleic Acids Research
論文:The flap endonuclease-1 promotes cellular tolerance to a chain-terminating nucleoside analog, alovudine by counteracting the toxic effect of 53BP1
DOI:10.1093/nar/gkaf617