東京工業大學科學技術創成研究院的原亨和教授和元素戰略研究中心主任細野秀雄榮譽教授等人,成功開發出了在低於50℃的溫度下讓氫和氮合成氨的新觸媒。這種觸媒是鈣結合了氫和氟的 「氫化氟化鈣(CaFH)」與釕(Ru)奈米顆粒的複材「Ru/CaFH」,可以在室溫下讓氫和氮合成氨。
原教授等人著眼於CaFH在低溫下提供電子的能力較強這一特點,開發成功了這款低溫合成氨的觸媒。這種觸媒的誕生不僅能大幅提高氨的生產效率,還有望利用自然能源實現溫室氣體二氧化碳的零排放。
氨作為肥料為全球70%的人口提供了生命保障,是人類必須的化學物質。利用觸媒可通過氫和空氣中的氮製造出氨來,不過,原料氫是利用甲烷等化石資源生產的,因此二氧化碳排放量佔總排放量的3%以上。
但以往的觸媒,必須在近400℃的高溫下才能使氫和氮合成氨。以往製氨過程中即使利用自然能源發電,大部分發電量也被用在了製氨上,無法生產足夠的氫。開發能大幅降低用氫氮製氨的溫度的觸媒,將為不排放二氧化碳的氨生產開闢道路。
背景
氨(NH3)是利用觸媒通過氫(H2)和空氣中的氮(N2)製造出來的化學物質,作為肥料,為70%的人口提供了生命保障,是人類生產最多的化學物質,年產量達1.7億噸。不過,氨雖然對人類非常重要,但隨著地球變暖,其製造過程已經成為一個大問題。
問題出在從何處獲得氫上。目前,氫是通過天然氣、煤炭和石油等化石資源生產的。其結果是會產生大量的二氧化碳,超過總排放量的3%。只要人口持續增長,利用化石資源生產氨,所產生的二氧化碳排放量就會持續增加(圖1)。
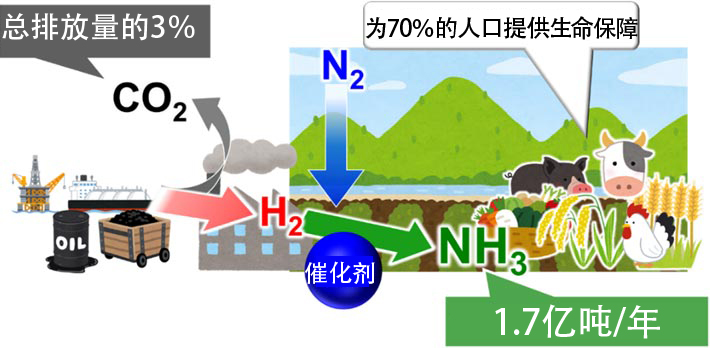
圖1:氨與人類社會以及製氨存在的問題
作為在不排放二氧化碳的情況下生產氨的方法,人們一直在考慮利用自然能源發電(圖2)。通過風力和光伏發電電解水的話,可以在不排放二氧化碳的情況下獲得清潔的氫。以這樣獲得的氫為原料,人類就能在不排放二氧化碳的情況下獲得氨,而且不必擔心化石資源枯竭。
不過,這種方法存在一個大問題,即通過氫和氮合成氨的現有觸媒需要400℃左右的高溫。利用電力產生高溫時需要消耗大量能源,這樣來自自然能源發電量中有一大半都被用於產生高溫以便讓氫和氮合成氨,能用來電解水生產氫的電力將變得不足。要想實現利用自然能源生產氨的計劃,就需要大幅降低氫和氮合成氨的溫度。
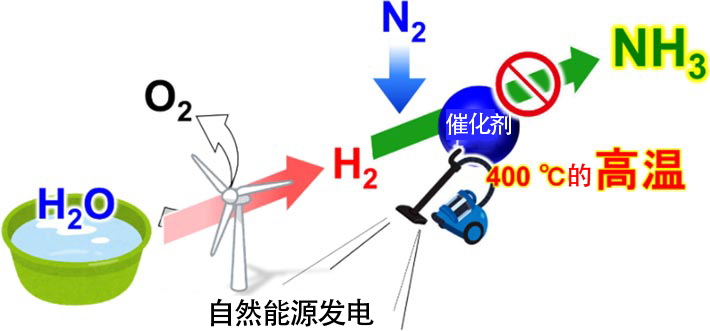
圖2:使用自然能源的氨生產
研究成果
1. 新方法
在此背景下,原教授等人構思了氨合成觸媒在非常低的溫度下工作的新方法。圖3是氨合成觸媒的溫度與氨合成速度之間的關係。正如砂糖在熱水中的解凍速度比在冷水中快一樣,氨合成速度也會隨著溫度的升高而加快。此前一直認為,在高溫下發揮高性能的觸媒在低溫下也會發揮相應的高性能。但原教授等人的研究顯示,此前開發的所有觸媒在100~200℃的溫度下就會變得完全故障。
也就是說,利用以往的方法開發出工作起點溫度為100~200℃的觸媒,斜率大的觸媒被視為高性能觸媒(圖3紅線部分)。雖然這些觸媒在高溫下的合成速度會加快,但低溫下的合成速度則基本為零,所以使用時無法大幅降低溫度。
人們一直在嘗試將觸媒的工作溫度降至50℃以下,也就是把溫度-氨合成速度曲線移至低溫側的方法(圖3藍線)。這樣低溫區域的氨合成速度會顯著提高,但此前並沒有成功過。
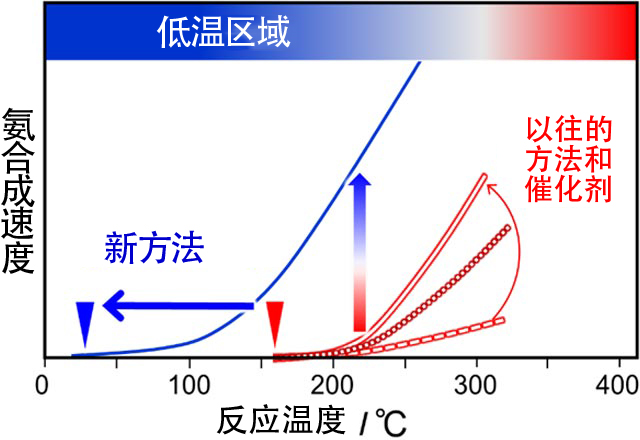
圖3:氨合成速度-反應溫度曲線
2. 新電子供體材料CaFH
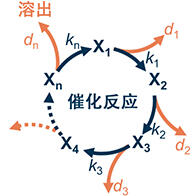
原教授等人首先著手開發了在低溫下也能蠻力提供電子的材料(電子供體材料)。氨合成中的最大困難是氮分子N2分解成氮原子的過程。氮分子是由兩個通過強鍵結合氮原子組成的穩定分子。要想將氮分子分解成原子,需要通過鐵等過渡金屬暫時向氮分子提供電子(圖4)。
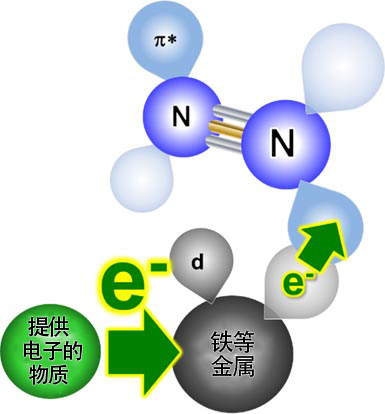
圖4:通過向金屬提供電子加速分解氮分子
因此,原教授等人著眼於常見的脫水材料「氫化鈣CaH2」(圖5)。CaH2是Ca2+的陽離子與氫的陰離子H–(氫化物離子)結合的離子性固體,溫度加熱到200℃以上後,部分H–會以氫分子的形式逸出,將電子留在Ca2+離子周圍(2H–→H2↑+ 2e–)。這種狀態下的電子具有與鹼金屬相當的電子提供能力(較大的離子化傾向),因此通過該電子提高過渡金屬的電子提供能力的話,N2分子可以分解成氮原子。不過,由於Ca2+—H–的離子結合能較強,無法在低溫下使用。
於是,原教授等人決定加入能與Ca2+形成更強結合的陰離子,削弱Ca2+—H–的結合能。Ca2+—F–的結合能是Ca2+—H–的2倍,因此如果將CaH2的部分氫化物離子置換為F–,形成氫化氟化鈣CaFH,那麼這種氫化物離子在低溫下應該會以氫分子的形式解離,從而在低溫下發揮較強的電子提供能力(圖5)。在實際合成的CaFH中確認,氫化物離子從室溫上下的溫度開始以氫分子形式逸出。
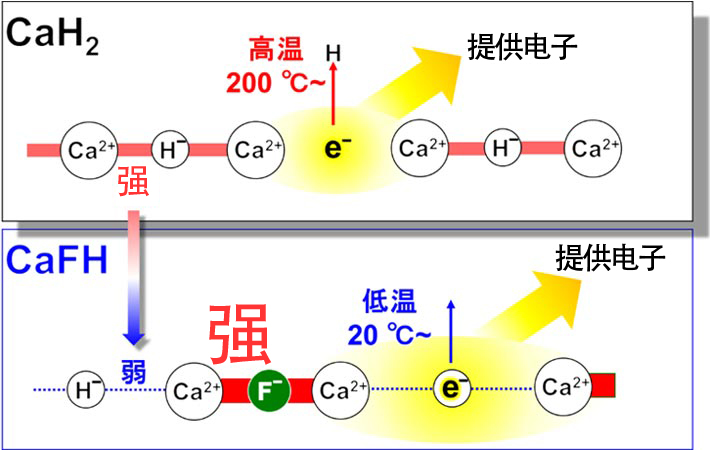
圖5:CaH2和CaFH的結合強度、析氫溫度及電子提供
3. 釕奈米顆粒-CaFH複材觸媒(Ru/CaFH)的氨合成能力
圖6是釕(Ru)奈米顆粒-CaFH複材觸媒(Ru/CaFH)的電子顯微鏡照片。這種觸媒是在CaFH的基底(灰色)接合了直徑為數奈米的Ru奈米顆粒(白色)的固體材料。觀察發現,該觸媒在低於100℃的溫度下也能合成氨,甚至在50℃時也會發揮作用(表1)。這表明,在低於50℃的溫度下也能合成氨。實際上,已利用光譜法確認,這種觸媒在室溫下也能通過氮分子合成氨。而目前製氨使用的鐵觸媒,以及最近剛剛發布的最高性能觸媒和排名第二位的觸媒在低於100℃的溫度下時則完全無法工作。在100℃以下的溫度下與Ru/CaFH進行比較對其他觸媒不公平,因此表2顯示了200℃下的結果。200℃時Ru/CaFH的性能為最高性能觸媒的2倍以上,即便在高溫下也超過了現有觸媒。

圖6:Ru/CaFH的電子顯微鏡照片
另外,Ru/CaFH的活化能為20kJmol-1(表1),只有目前氨合成觸媒的1/2左右。另外,Ru/CaFH是穩定的觸媒,即使在300℃以上的反應溫度下,也能連續工作900多個小時而不降低氨合成速度。
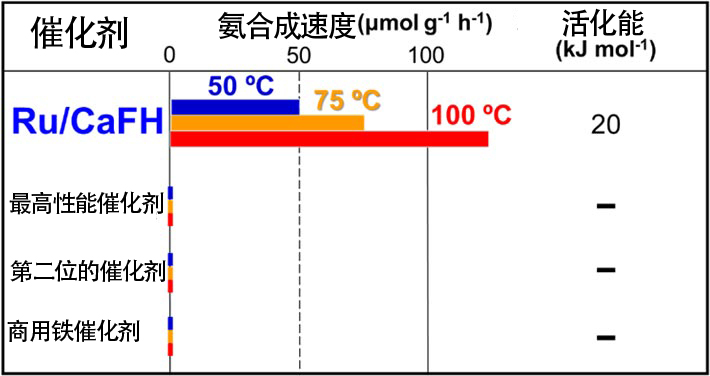
表1:Ru/CaFH的觸媒性能(100℃以下)
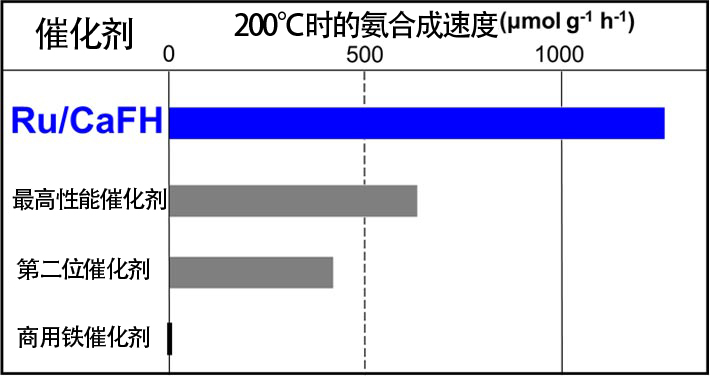
表2:Ru/CaFH的觸媒性能(200℃)
4. Ru/CaFH的催化機制
圖7是通過各種解析明確的Ru/CaFH的催化機制。首先在室溫前後,氫原子從CaFH中逸出,留下電子。在此狀態下,CaFH具有與金屬鉀相同的強電子提供能力,會向Ru蠻力提供電子(圖7下)。氮分子N2與該狀態下的Ru接觸後,N2立即分解為N原子。在Ru表面,氫分子H2分解生成H原子,因此氮原子與氫原子直接反應,生成氨NH3。研究確認,這個過程在室溫下也能進行。
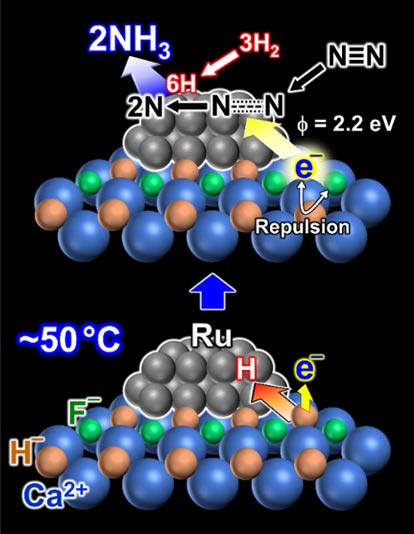
圖7:Ru/CaFH的催化機制
未來展望
此次開發的Ru/CaFH有兩個意義。
第一,通過降低觸媒最低工作溫度的新方法及開發使該方法成為現實的新觸媒材料,氨合成觸媒的性能在300℃以下的低溫區域顯著提高。
第二,實現了在低於100℃的溫度下也能工作的觸媒。以往的觸媒在100℃以下會失效。因此,無論怎樣改良,也無法在低於100℃的溫度下合成氨,而Ru/CaFH能在室溫下合成氨。正如以往的觸媒通過以往的方法提高了性能一樣,Ru/CaFH或者以其為基礎的觸媒性能有非常大的提高空間。
論文資訊
論文題目:Solid solution for catalytic ammonia synthesis from nitrogen and hydrogen gases at 50℃
發表期刊:Nature Communications
DOI:10.1038/s41467-020-15868-8
文:JST客觀日本編輯部