研究背景
蛋白質濃度升高後會凝集,形成名為「低聚體」的球狀物質和名為「澱粉樣蛋白纖維」的針狀物質。這些蛋白質凝集體會引發30多種疾病,例如,阿茲海默症就被認為是β-澱粉樣蛋白(Aβ)肽凝集形成的低聚體和澱粉樣蛋白纖維在大腦中累積引起的。此前已有研究發現,神經細胞膜表面等親水性和疎水性界面會促進Aβ肽的凝集,不過一直不太清楚為什麼Aβ肽容易在細胞膜表面凝集。此次,日本分子科學研究所的研究人員利用基於計算機的分子動力學仿真和核磁共振光譜實驗對此展開了研究。查明Aβ肽的凝集機制有望在將來應用於新藥開發,從而抑制阿茲海默症致病物質的生成。
研究成果
研究發現,Aβ肽同時擁有親水性胺基酸殘基和疎水性胺基酸殘基,因此能比較穩定地存在於細胞膜表面等親水性和疎水性界面。另外還發現,Aβ肽中疎水性胺基酸殘基較多的區域有兩處(被稱做β1區的第13-20個胺基酸殘基和被稱做β2區的第31-36個胺基酸殘基),但在細胞膜表面,β1區與β2區之間的β髮夾結構(下圖中黃色箭頭↑↓處)比在水中更多。如圖所示,Aβ肽的一部分直線延伸並在其間形成氫鍵,從而形成β髮夾結構。直線延伸的部分與附近的其他Aβ肽也容易形成分子間氫鍵,Aβ之間相互強烈吸引並排列到一起。這些Aβ肽不斷相連形成大面積的塊體,因此容易凝集。另外,Aβ肽容易相互結合的結構也是促進Aβ肽在細胞膜表面凝集的原因。
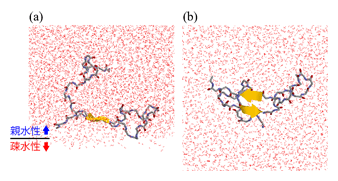
圖:(a)Aβ肽在親水性和疎水性界面形成β髮夾結構的情形。
(b)從下向上看(a)時。
文 JST客觀日本編輯部
日文發布全文 [網路位址]