2018年9月28日,復旦大學醫藥健康產業發展戰略研究中心徐麗麗等作者在《自然》雜誌上發文,綜述了中國藥品監管體系過去三年來大刀闊斧改革取得的卓越成效。11月26日,南方科技大學副教授賀建奎主導的「轉基因嬰兒」降生的爆炸性新聞(圖1),則將中國臨床監管和倫理審查的問題推上了風口浪尖。
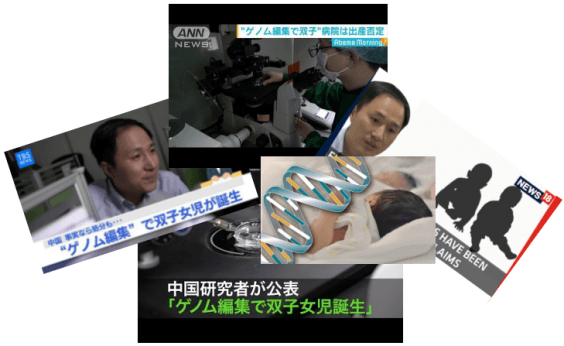
圖1 日本媒體廣泛關注轉基因雙胞胎女嬰事件
中國主要免疫細胞治療事件彙總如下:
・ 2018年6月,中國首個CAR-T療法致死引發的訴訟在徐州市開庭。
・ 2018年3月13日,南京傳奇生物獲得中國首個CAR-T免疫細胞治療臨床試驗批件[1],但煙火研究報告顯示該公司已於2014-2017年間對71名患者進行了臨床試驗[2];
・ 2017年11月,一名白血病患者在接受蘇州佰通生物CAR-NK免疫細胞治療後死亡;
・ 2017年10月,ClinicalTrials.gov上註冊的正在中國開展的CAR-T臨床研究已經多達132個(每個臨床募集患者數名到上百名不等);
・ 2017年9月,在上海長征醫院接受傳奇生物CAR-T療法的患者由於發生細胞介素風暴而死亡(圖2);
・ 2016年4月,發生百度競價排名武警北京第二醫院生物免疫醫療的「魏則西事件」;
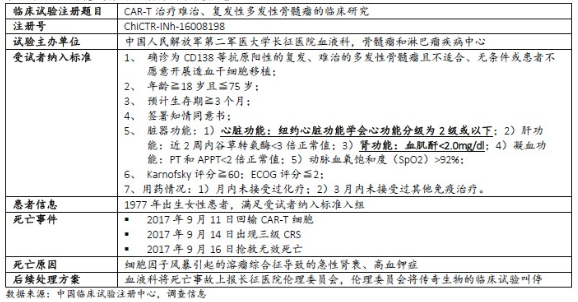
圖2 南京傳奇CAR-T臨床試驗患者死亡事件 (圖:煙火研究)
首先,我們明晰一下再生醫療(Regenerative Medicine)、細胞治療(Cell Therapy, Cellular Therapy, Cytotherapy)和基因療法(Gene Therapy)三個基本概念。總的說來,三者是根據不同的角度來進行定義的,所以相互之間既有重疊的部分,也有不同的地方(圖3)。再生醫療談的是目的和結果,細胞治療強調的是材料或工具,基因療法則突出的是手段或技術。狹義的再生醫療主要是基於有活性的細胞或組織來實施治療,按照歐洲科學基金會(European Science Foundation, ESF)的定義,採用非細胞的手段來達到組織分化和機能再生的目的仍然屬於再生醫療的範疇。美國食品藥品監督管理局(FDA)解釋細胞治療是「通過將體外處理或改造過的自體、異體、異種來源的細胞輸入人體以達到對疾病或創傷預防、治療、緩解的目的」。
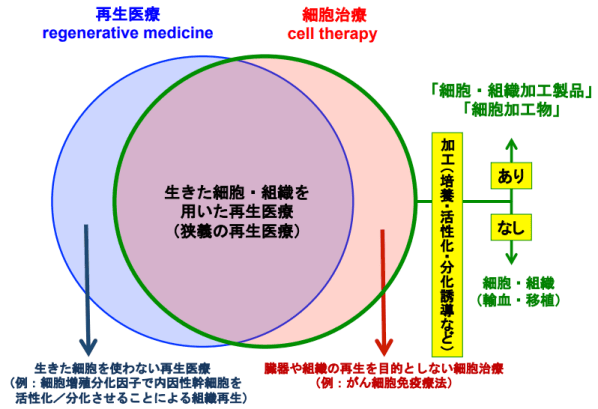
圖3 再生醫療與細胞治療概念比較 (圖:國立醫藥品食品衛生研究所NIHS)
細胞治療和基因療法的範疇也有所交叉。細胞治療既可以是將患者自體的自然殺手細胞(Natural Killer Cell,NK)、CIK細胞(Cytokine induced killer cell)及樹狀細胞(Dendritic cell)等免疫細胞進行體外篩選、分離、增殖、回輸,也可以是將分離後的自體細胞進行基因工程改造後再擴增回輸,比如前述的CAR-T療法。而後者同時也屬於體外基因療法的範疇,根據日本《再生醫療等安全性確保法》規定,其臨床研究需由再生醫療特定委員會來審查;基因療法也可以包括通過溶瘤病毒、質體等體內直接施藥的治療方式,屬於基因療法臨床研究審查委員會負責(圖4)。另外,溶瘤病毒和免疫檢查點抑制劑、細胞治療、腫瘤疫苗等,都是目前免疫治療主要的研究分支。
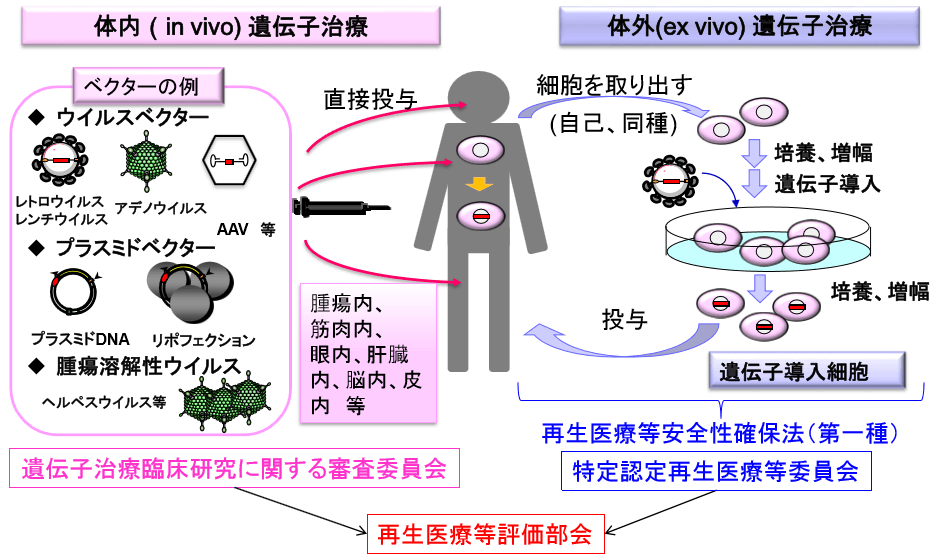
圖4 基因療法臨床研究監管 (圖:日本基因療法學會)
在很多國家的非傳統醫學或替代醫學(Alternative medicine)中,很早就有人試圖通過輸入動物的細胞成分或者其他健康年輕人的血液來治病或養生。但由於嚴重的不良反應,也讓很多嘗試者付出了鮮活的生命。由於替代醫學往往與已有科學共識相矛盾,通常被證明無效、未經證明或者無法短時證明,所以美國國家癌症研究所(National Cancer Institute, NCI)明確表示反對替代醫學的臨床應用。上世紀60年代,上海地區曾對「打雞血」進行了15000多人次的臨床試驗(圖5);1965年7月23日,中國原衛生部下發《關於「雞血療法」的通知》,禁止醫務人員用鮮雞血給病人治病[3]。

圖5 上世紀曾風行一時的「打雞血」 (圖:人民網)
1968年,大洋彼岸的明尼蘇達州,人類歷史上第一例骨髓移植手術成功實施。但直到上世紀80年代免疫學發展史上的黃金時代,免疫細胞療法才真正開始了科學系統的研究。1985年,T細胞生長因子IL-2被發現能夠讓轉移性黑色素瘤患者長期病情緩解。1988年,科研人員首次證實使用患者自身腫瘤浸潤性淋巴細胞(Tumor Infiltrating Lymphocytes, TILs)的過繼性細胞療法 (Adoptive Cell Therapy, ACT)能夠使轉移性黑色素瘤患者產生客觀應答。此後,從患者自體血液中分離出免疫細胞,將這些細胞體外培養後再輸回患者體內去攻擊腫瘤的主動細胞療法一般作為化療和放療的輔助療法。
1985年,京都大學的勅使河原計介醫學博士到美國達特茅斯學院進修,歸國後發明了較LAK療法活性更高的ANK療法(Amplified Natural Killer Therapy)。1993年,ANK療法基本模製,後經小規模臨床試驗,2001年正式進入一般診療(圖6)。
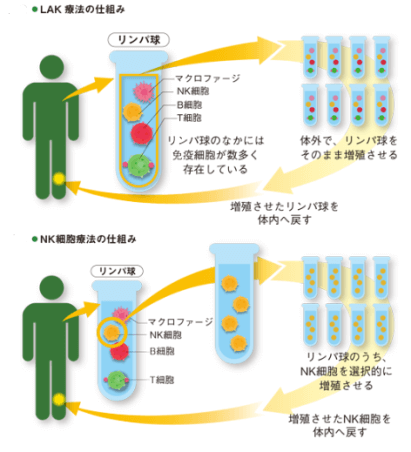
圖6 LAK和NK細胞療法示意(圖:BSL-48)
2009年,中國原衛生部公佈《醫療技術臨床應用管理辦法》,免疫細胞治療技術和基因療法技術,都被歸為「涉及重大倫理問題,安全性、有效性尚需經規範的臨床試驗研究進一步驗證的醫療技術」。同年5月22日,「自體免疫細胞(T細胞、NK細胞)治療技術和細胞移植治療技術(幹細胞除外)」被納入《首批允許臨床應用的第三類醫療技術目錄》之中。
2015年7月2日,中國國家衛計委發布《限制臨床應用的醫療技術(2015版)》目錄,同時廢止《首批允許臨床應用的第三類醫療技術目錄》。免疫細胞治療被要求「按照臨床研究的相關規定執行」。
2016年5月4日,「魏則西事件」發生後,中國國家衛計委緊急召開由省、市、縣三級衛生計生委醫政醫管負責人及二級以上醫院院長參加的全國電視電話術會議。會議重申免疫細胞療法屬臨床研究。免疫細胞療法被明令禁止臨床應用,即在大陸任何醫院或機構收費進行免疫細胞治療屬於違法。
同期,日本逐步放開對中國遊客的「個人旅遊簽」和「醫療簽證」(3年有效,最長可逗留半年)。近年來,除了癌症患者,中國先富階層出於「抗老化」、「延壽」等非醫學目的到日本接受自體免疫細胞療法的高端定製旅遊也出現井噴態勢,吸引到大量華人資本前來佈局。
供稿 宋傑 東京大學博士
編輯修改 JST客觀日本編輯部
相關鏈結:
1. 《財經》:中國首例CAR-T療法訴訟案反思:臨床試驗安全如何保障? [網路位址]
2. 閻火研究報告 [網路位址]
3. 人民網:「雞血療法」 [網路位址]













