順天堂大學醫學研究科基因體與再生醫療中心的赤松和土特聘教授、志賀孝宏研究員,和慶應義塾大學醫學部生理學教研室的岡野榮之教授、西原浩司助教等帶領的共同研究團隊,通過向人工誘導多功能幹細胞(iPS細胞)培養基中添加3類小分子化合物,成功使iPS細胞的分化和成熟能力得以顯著提高[1]。該新技術成果已於2019年1月31日公開發表在國際幹細胞學會(ISSCR)的官方科學雜誌《Stem Cell Reports》上[參考文獻1]。
由於iPS細胞能夠被誘導分化成各類不同的細胞組織,所以在其發現十多年來迅速被廣泛應用於再生醫療、新藥開發、疾病機制研究等。從2014年在眼疾領域首次開啟臨床試驗後,更是在2018年進入井噴態勢(圖1)。但是iPS細胞的製備較為耗時,每個細胞株的分化成熟能力迥異,所以在再生醫療應用前必須先甄別篩選出分化成熟能力較強的高效細胞株。這些繁瑣的操作導致目前iPS細胞應用中耗費大量人力、物力和時間的不足。
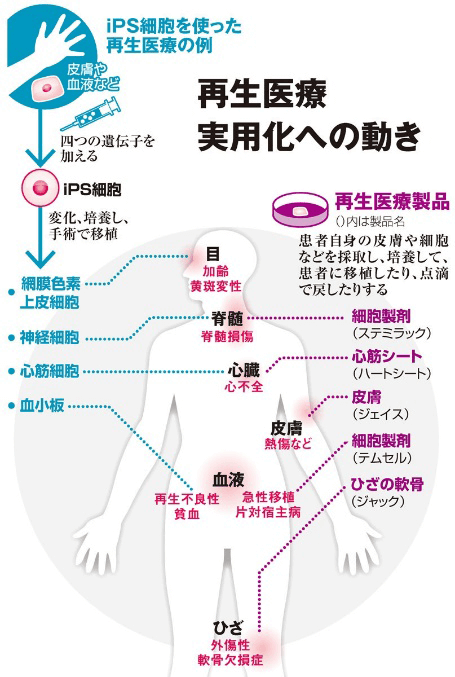
圖1 iPS細胞再生醫療實用化動向 (《朝日新聞》)
本次研究中,科研團隊利用小鼠體細胞製備IPS細胞時,向處於重程式設計階段(reprogramming period)的體細胞培養體系中添加了MEK抑制劑(PD184352)、GSK3β抑制劑(CHIR99021)、FGF接受者抑制劑(SU5402)三類小分子化合物。發現和未添加化合物的對照組相比較,添加後所有細胞株的分化誘導時間整體縮短,分化成熟早期的標誌基因表現顯著增強(圖2)。而且,當重程式設計階段結束後再添加上述三類化合物,對整體分化和成熟能力的提高不會產生明顯影響。
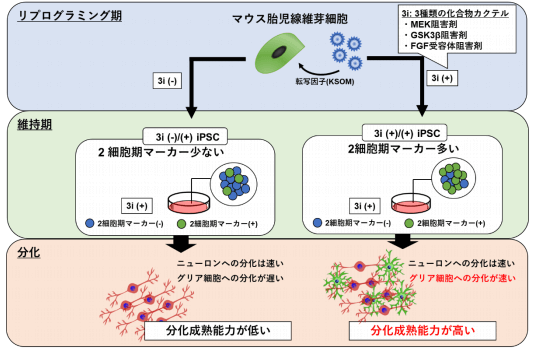
圖2 添加3i後iPS分化成熟能力提高 (新聞稿)
在疾病治療的臨床實務中,與時間賽跑是至關重要的一點。但是目前人工誘導後的iPS細胞,和正常體內幹細胞相比,成熟為最終分化目的細胞的時間往往更長。而且即使同一供體的體細胞在相同的製備條件下,得到iPS細胞的分化成熟能力也大不相同。再生醫療實務中,未分化的iPS細胞將來有形成腫塊的風險,所以先花費大量時間進行高效iPS細胞均一化篩選。
本實驗中,由小鼠體細胞製備出的iPS細胞先成熟為神經幹細胞,再繼而最終分化成神經元和神經膠細胞。以往常規的iPS細胞製備方法,得到的神經幹細胞分化為神經膠細胞的能力極低。而當在重程式設計階段添加3類化合物後,神經幹細胞短時間内即獲得了分化成神經膠細胞的能力(圖3)。實驗同時證明,重程式設計階段的培養條件和重程式設計階段完成後的培養條件相比,對iPS細胞最終分化和成熟能力的決定性更大。
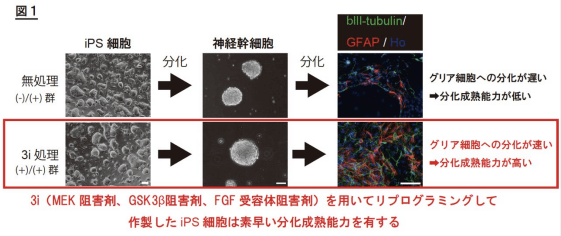
圖3 神經幹細胞分化成熟為膠質細胞能力提高 (新聞稿)
另外,一般說來哺乳動物胚胎發生需要經歷受精卵到2細胞期、4細胞期、8細胞期…囊胚期等的階段化發育。但本實驗中當添加3類化合物後,所製備得到的iPS細胞顯著增加了2細胞期的特有標誌性基因群的表達。儘管目前該躍進機制還不明確,但可以肯定的是重程式設計階段培養條件的改變導致了特徵基因表現模式的改變。
本研究從一個全新的角度,通過改變重程式設計階段的培養條件來促進iPS細胞的分化和成熟。期待該技術最終能運用到再生醫療實務中,提高iPS細胞的製備和分化速度,和患者一道跑贏病魔。
供稿 宋傑 東京大學博士
編輯修改 JST客觀日本編輯部
參考文獻:
1.Koji Nishihara, et al.Induced pluripotent stem cells reprogrammed with three inhibitors show accelerated differentiation potentials with high levels of 2-cellstage marker expression. Stem Cell Reports. https://doi.org/10.1016/j.stemcr.2018.12.018













