日本慶應義塾大學醫學部的吉村昭彥教授與美國拉霍亞免疫與過敏研究所的Anjana Rao教授等人組成的研發小組,利用小鼠模型查明瞭腫瘤内的免疫細胞(T細胞)耗竭的分子機制,並證明通過抑制該機制,能實現更加有效的癌症治療。
近年來,Opdivo(抗PD-1抗體)等癌症免疫療法備受關注。免疫檢查點主要在T細胞中表達,是抑制過度免疫反應的系統。抗PD-1抗體通過抑制免疫檢查點和促進T細胞的活性來增強對癌症的攻擊力。但此前的研究發現,聚集在癌組織中的很多T細胞被多次刺激後,會高度表達多個免疫檢查點分子,從而陷入被稱作「耗竭」的功能不全狀態。完全耗竭的T細胞無法再通過抗PD-1抗體激活,會明顯削弱癌症免疫療法的效果。
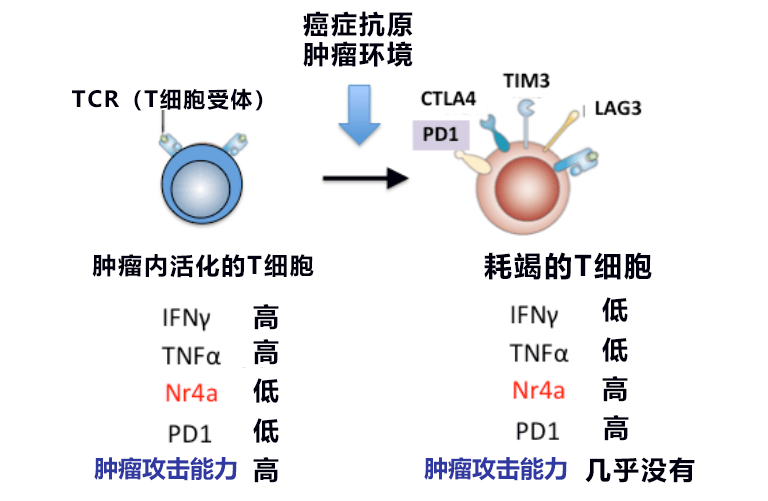
圖1:活化T細胞與耗竭T細胞的差異
此前科學家們完全不清楚造成T細胞耗竭的分子機制。此次研發小組著眼於隨著T細胞的耗竭而進行獨特性表達的轉錄因子Nr4a,發現Nr4a會與PD-1基因的增味劑區域結合,增強PD-1的表達並使之穩定。而使Nr4a基因缺失,則避免了T細胞耗竭,長期保持了活化狀態。
另外,實驗發現,即使向小鼠腫瘤模型植入野生型T細胞,90天后所有小鼠依然全部因癌症死亡,但如果植入缺少Nr4a的T細胞,則70%以上的小鼠能存活。也就是說,轉錄因子Nr4a在使腫瘤内聚集的T細胞「耗竭」的過程中發揮了主要作用,對抗腫瘤效果至關重要。開發Nr4a抑制劑有助於實現有效的癌症免疫療法。
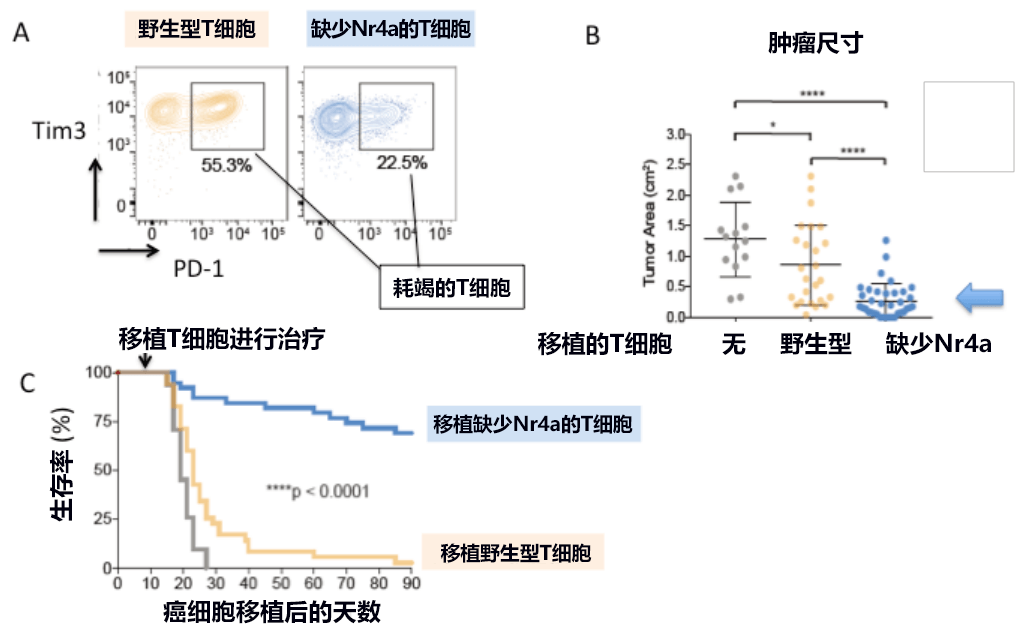
圖2:缺少Nr4a基因的T細胞難以耗竭,抗腫瘤能力高
相關論文已於2019年2月27日發表在英國科學雜誌《自然》的網路速報版上。
文 JST客觀日本編輯部














