橫濱市立大學大學院醫學研究科臟器再生醫學教授谷口英樹,2014年在接受美國貝克曼庫爾特公司(Beckman Coulter, Inc.)採訪時表示,爭取在2019年讓肝芽移植進入臨床研究階段[1]。五年後,谷口教授踐行了他的承諾。2月23日,橫濱市大的研究團隊明確表示,將在今年夏天向負責審查再生醫療的慶應義塾大學專家委員會提交「向重症肝病嬰兒移植iPS細胞由來肝芽」的臨床研究計劃(圖1)[2]。
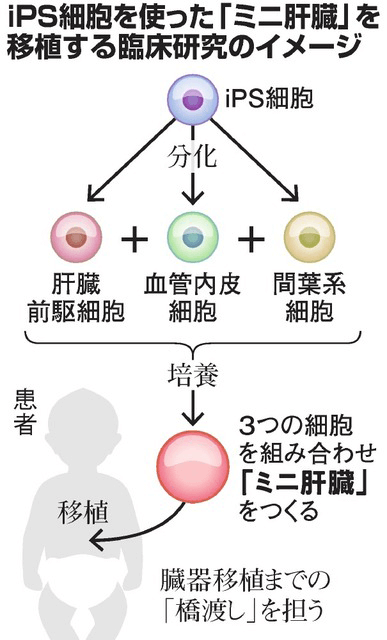
圖1 iPS細胞由來肝芽移植臨床研究
2013年,谷口教授和時年26歲的得意門生武部貴則(現為「日本最年輕的教授」)一道建立了模擬胎兒臟器形成過程的技術:利用iPS細胞(人工誘導多功能幹細胞)分化出肝臟各類組織細胞,體外混合培養後長成直徑5毫米的肝芽(迷你肝)(圖2),然後移植到肝功能耗竭的模式小鼠體內後成功大幅提高了小鼠的生存率(《Nature》,2013)[3]。當年谷口教授提到,「希望能在10内將再生肝臟推向臨床應用,這對救治重症肝炎的新生兒尤為重要」。

圖2 iPS細胞生成的直徑3毫米的肝芽 (圖片:橫濱市大)
谷口教授外科醫生出身,親手執刀了無數肝臟移植手術。肝臟是人體內最大的内髒器官,本身具有極強的再生能力,即使割掉九成僅剩一成也能自行恢復到原來大小。親眼目睹肝臟強大的再生力和患者驚人的自愈力,讓谷口教授萌發了通過iPS細胞製成肝芽,然後移植到患者體內自我複原的想法。
利用iPS細胞製備像肝臟等大型臟器的難度非常大。當時由iPS細胞生成内髒器官組織細胞已有多例報導,但總體存在分化效率低、重現性差、移植到小鼠體內後著床存活率低等問題。谷口教授研究團隊的立題終點是製備可用於移植的肝芽,所以從一開始就計劃模擬人體肝臟製作具有各類組織細胞的集合體,而非肝細胞一類。該團隊先用iPS細胞分化製備了肝祖細胞、血管內皮細胞和間充質細胞,然後將3類細胞混合培養成具有正常肝臟機能的功能性肝芽(圖3)。而且和以往直接將iPS細胞誘導分化相比,通過肝芽形式誘導分化成肝細胞效率也大幅提到。
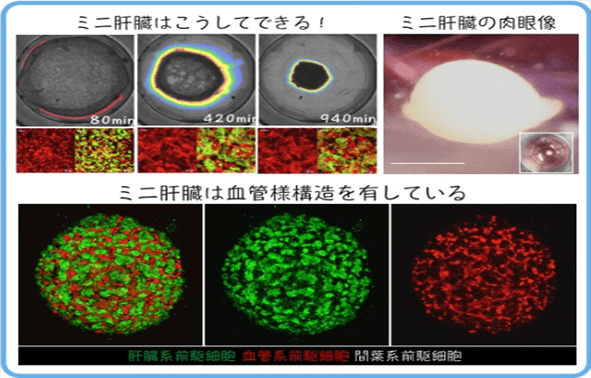
圖3 iPS細胞誘導成3類肝芽組成細胞 (圖片:橫濱市大)
而且,將肝芽移植到免疫缺陷小鼠的腦脊髓後,第二天即可觀察到血管聯通和血液流動的現象(圖4)。這個速度也著實讓谷口教授一驚,因為根據臨床經驗,人體肝臟移植手術後到血液貫通一般需要十天的時間。
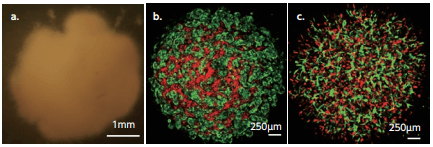
圖4 iPS細胞生成肝芽 (圖片:橫濱市大)
使用iPS細胞進行臨床試驗的移植細胞數,慶應大學的脊髓傷害研究約為200萬個,大阪大學進行心臟耗竭治療約為1億個,本次臨床申請則為數億個細胞。大數量分化細胞的製備及移植後的緊迫反應等,都具有一定的挑戰。
用於臨床研究的肝芽的製備必須符合GMP生產標準(Good Manufacturing Practice),同時要滿足規模化和安全性兩方面要求。為瞭解決規模化製備的問題,2017年,研究團隊通過產學研連攜體制與Helios Corp、可樂麗(Kuraray Co.)、味之素、尼康等公司展開合作,最終實現了億級數量肝細胞的一次性製備工藝平台的搭建(《Cell Reports》,2017)(圖5)。
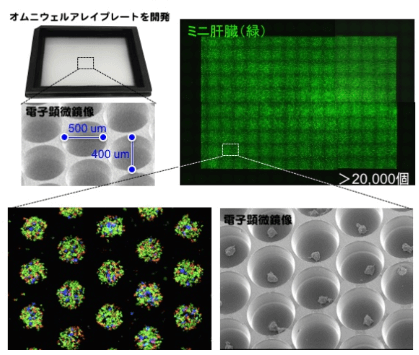
圖5 規模化肝芽製備平台(圖片:橫濱市大)
從細胞安全性以及後續產業化角度出發,本研究團隊最終選用了京都大學iPS細胞研究所(CiRA)iPS細胞庫的標準細胞株。本次提交的臨床試驗申請若能順利通過審議,預計2020年即可實施移植手術。
供稿 宋傑 東京大學博士
編輯修改 JST客觀日本編輯部
相關鏈結:
1. 《Nature》日本版2014.7.3
2. 朝日新聞關於肝芽移植臨床研究報導
3. 【日本iPS細胞研究報告(三)】橫濱市立大學篇:用iPS細胞培育肝腸腎肺心等臟器













