2019年3月5日,日本厚生勞動省的專家委員會有條件地通過了大阪大學關於iPS細胞(人工誘導幹細胞)由來角膜細胞移植的臨床研究申請[1]。大阪大學大學院醫學系研究科眼科學西田幸二教授等的研究團隊,最快將於今年六月給第一名患者實施手術(First-in-human trial)(圖1)。
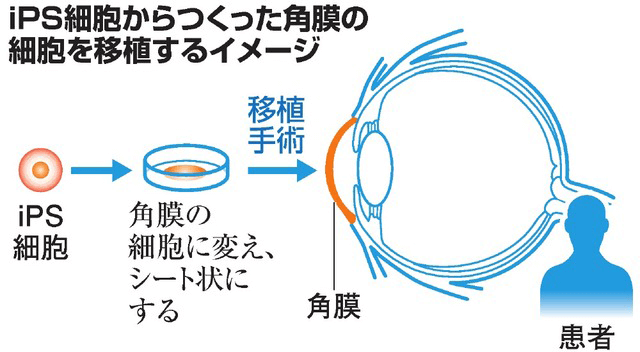
圖1 iPS角膜移植示意圖
本次臨床試驗首批招募入組的是4名「角膜緣功能耗竭症」患者。角膜緣(Corneal limbus),又稱角鞏膜帶、角膜緣部、邊緣部角膜、角膜邊緣區、角鞏膜緣、角鞏膜界等,是透明的角膜(Cornea)同白色鞏膜(Sclera)交界部分的一條半透明灰白色過渡帶(圖2),與結膜(conjunctiva)的鑑別標誌是不含杯狀細胞。角膜緣幹細胞群(Limbal stem cells),又稱角膜上皮幹細胞群(corneal epithelial stem cells),是眼睛表皮細胞自我修復與再生的重要來源。
角膜緣功能耗竭症(limbal stem cell deficiency, LSCD; 角膜上皮幹細胞疲弊症)是一類由於外傷或其他疾病導致角膜上皮幹細胞不足或功能耗竭的眼表疾病。致病原因包括燒傷、酸鹼腐蝕、Stevens-Johnson症候群(Stevens-Johnson syndrome,SJS)、眼瘢痕性類天皰瘡、神經源性角膜病灶、慢性角膜緣炎、乾燥性角結膜炎、翼狀胬肉等。由於結膜上皮層侵入角膜内,原本透明的角膜被伴有血管的結膜組織覆蓋,導致角膜高度渾濁、視力模糊甚至完全失明,患病率高、致盲性極強且不易治癒。
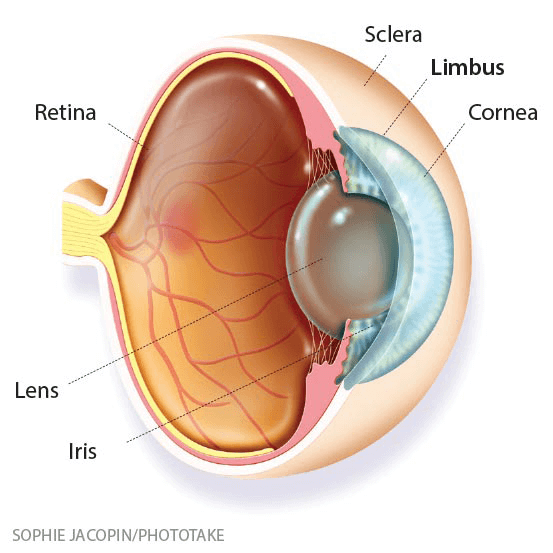
圖2 角膜緣位置示意 (ManagedCare/圖)
此前大阪大學西田幸二教授(眼科)與林龍平教授(幹細胞應用醫學)的研究團隊,通過誘導iPS細胞開發出了能夠自我形成眼睛多種細胞系的外胚層自主性多區(self-formed ectodermal autonomous multi-zone, SEAM)結構(圖3)。2018年,上述團隊又與樂敦製藥、以及蛋白質研究所的關口清俊教授等合作,發現層粘連蛋白(Laminin)的種類可以決定iPS細胞的分化命運,並由此成功誘導分化出了眼睛神經嵴細胞、角膜上皮細胞、視網膜/角膜多層構造等 (《Cell Reports》, 2018) [2]。
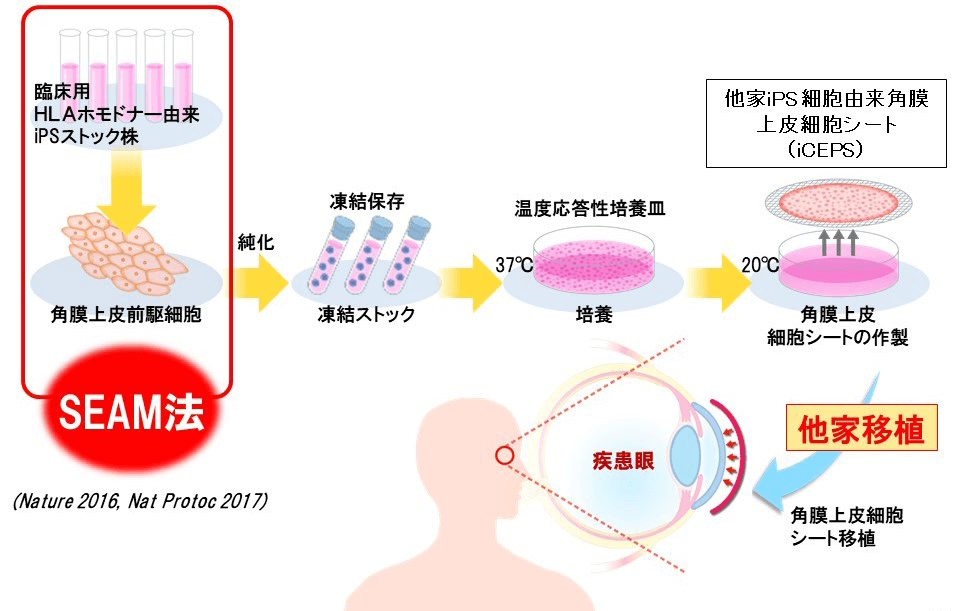
圖3 SEAM法制備iPS角膜並移植
本次臨床試驗,先將異體iPS細胞分化誘導為角膜細胞,然後製備成厚約0.05毫米的角膜片層(大約三四百萬個細胞),再移植給患者(圖4)。前期動物實驗中,移植的角膜上皮片層成功修復了失明兔子的視力。本次臨床研究中被移植的細胞片層有望可以持續生成角膜細胞並保持透明,以長期恢復患者視力。本次試驗的主要目的是評估該項眼表重建技術的安全性。
圖4 將被用於本次臨床試驗的iPS角膜
專家委員會要求對原臨床試驗計劃中患者知情同意書的部分内容進行修改,並在第二例移植手術完成半年後提交中期報告,討論研究後再實施後面兩例手術。
目前在日本至少有1600名患者在等候角膜移植的供體。另外傳統角膜移植也會引起排斥反應,iPS細胞由來的角膜移植理論上講可以避開排斥反應。西田教授表示,團隊會儘可能地既安全又快速地往前推進臨床研究,希望最終能作為一種標準醫療手段推廣開來。如果本次試驗成功,將在五六年内實現再生角膜的標準規模化生產。
供稿 宋傑 東京大學博士
編輯修改 JST客觀日本編輯部
相關鏈結:
1.大阪大學新聞通報
2.【日本iPS細胞研究報告(十九)】大阪大學篇:成功培育各類眼細胞













