京都大學發布新聞通報,該校iPS細胞研究所(CiRA)堀田秋津講師、王博研究員、徐淮耕博士研究生等研究團隊,成功開發出利用基因編輯製備具有極低排斥反應風險的iPS細胞(人工誘導幹細胞)的技術工藝(圖1)[1]。該技術成果已發表在2019年3月8日的《Cell Stem Cell》電子版上[文獻1]。
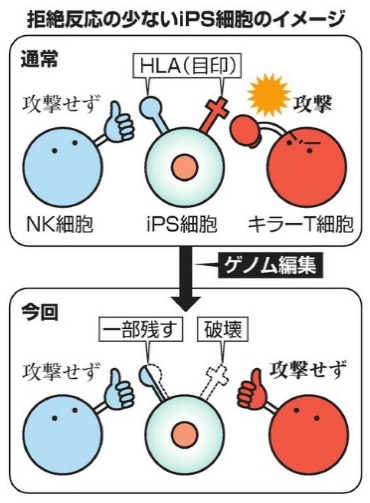
圖1 低排斥反應iPS細胞製備工藝
目前通過iPS細胞製備心肌細胞、神經細胞、肝細胞、胰腺細胞、軟骨細胞、眼細胞以及各類傷害組織細胞等,用於再生醫療的多個臨床研究正在如火如荼的進行中。將來如果不是通過患者自體而利用第三人血液預先製作並儲備iPS細胞,不論是整體治療花費還是細胞準備時間,都會大大降低。
但是,當異體來源的細胞進入患者體內後,移植排斥反應的風險依舊較高。這也是iPS細胞再生醫療實用化路上面臨的主要挑戰之一。本次技術路線,則使將來開發普適於大多數人群的iPS細胞變得簡單可行。
人體具有先天的排除自體癌變細胞和抵禦進入體內的外來異物的免疫機能。其中對外來或癌變細胞實施攻擊的最重要的兩類免疫細胞是細胞毒性T細胞和自然殺手細胞(Natural killer cell, NK cell)。研究團隊利用可自由修改目標基因的CRISPR-Cas9基因編輯技術,將細胞毒性T細胞用來識別是否是攻擊目標的標誌物人類白血球抗原(human leukocyte antigen, HLA)破壞掉,同時保留了指示體內自然殺手細胞不要攻擊的部分HLA標誌物(圖2)。
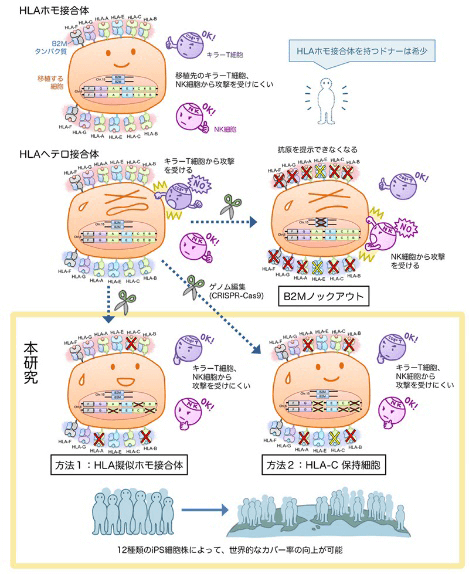
圖2 低排斥反應iPS製備原理
細胞毒性T細胞(cytotoxic T cell, Tc; cytotoxic T lymphocyte, CTL; T-killer cell; Cytolytic T cell; CD8+ T-cell; killer T cell),是T細胞中負責即時監控並殺死癌變或被感染細胞的成員。T細胞表面的T細胞接受者(T-cell receptors, TCRs) 負責識別由主要組織相容性復合體(MHC)所呈遞的抗原。
人類白血球抗原(HLA)的基因是目前已知人類體內最為龐大複雜的基因家族之一。HLA是人類組織相容性復合體的表達產物,是導致移植排斥反應的主要原因,又被稱為移植抗原。HLA按其分佈和功能分為Ⅰ類抗原、Ⅱ類抗原和Ⅲ類抗原。Ⅰ類幾乎分佈於身體全部細胞表面,Ⅱ類主要位於巨噬細胞和B淋巴細胞表面,補體等歸屬於Ⅲ類分子。
在器官和骨髓移植時,人類白血球抗原決定了組織相容性。在對移植供體和接受者選擇配對時,兩者的人類白血球抗原越相近,移植排斥反應就越輕,移植後存活率就越高。但人類白血球抗原完全相同的機率極小,隻存在於同卵雙胞胎或者基因選殖的情形下。另外HLA檢測在輸血法、先天遺傳性疾病診斷、親子鑒定等領域也有重要作用。
上個月,美國加州大學的研究團隊也剛剛宣佈製作成功不會引起任何排斥反應的iPS細胞。但和京大團隊不同的是,加州大學團隊通過基因編輯將HLA基因全部沉默。因此也引起新的擔憂,一旦被移植的細胞出現癌變或者病毒感染等異常情況,也不會被患者機體免疫細胞識別排除。
京大團隊將基因編輯後的iPS細胞,誘導分化為血液細胞。體外將製備的血液細胞與免疫細胞混合,和未經編針織輯過的iPS細胞相比較,幾乎觀察不到排斥反應。進一步將上述血液細胞移植到實驗小鼠體內,經過一週也未觀察到移植排斥反應(圖3)。通過體外和模式小鼠實驗,確認該技術工藝獲得血細胞能夠繞開細胞毒性T細胞和自然殺手細胞的攻擊,從而將移植排斥反應的風險降到最低。
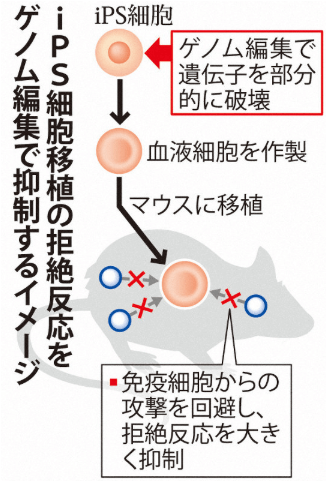
圖3 低排斥反應iPS確認實驗
基於對超過15萬人的HLA型調研,京大iPS細胞研究所為了儘可能降低將來實用化中的排斥反應,從低排斥風險HLA型健康人收集製備了涵蓋多類免疫型的iPS細胞庫。按照先前計算,約140種不同免疫型的iPS細胞株才能適用於90%的日本人群;如果利用本次的技術路線,理論上僅需要12種免疫型的iPS細胞株即可覆蓋包括日本人在内的亞洲、歐美及西班牙系人群的九成以上。京大團隊下一步將對基因編輯的安全性以及編輯後iPS細胞的分化性能進行確認。
供稿 宋傑 東京大學博士
編輯修改 JST客觀日本編輯部
參考文獻:
1 Huaigeng Xu, Akitsu Hotta, et al., Targeted Disruption of HLA genes via CRISPR-Cas9 generates iPSCs with Enhanced Immune Compatibility, Cell Stem Cell (2019), https://doi.org/10.1016/j.stem.2019.02.005
相關鏈結:
1 京都大學新聞通報













