2019年5月15日,日本厚生勞動大臣諮詢機構中央社會保險醫療協議會(中醫師協)在東京霞關召開的會議上(圖1),正式確認用於治療白血病的最新CAR-T免疫細胞療法Kymriah(日文名:キムリア;通用名:Tisagenlecleucel)被納入基本醫療保險,5月22日起開始實施[1]。

圖1 5月15日召開的東京霞關中央社會保險醫療協議會
由瑞士諾華製藥 (Novartis) 生產的Kymriah(圖2),醫保定價為3349萬3407日元。同款療法在美國針對白血病和淋巴瘤兩個適應症的定價分別為47.5萬美金(約5200萬日元)和37.3萬美金(約4100萬日元)。Kymriah創下日本目前歷史最高藥價紀錄。諾華製藥認為其定價比骨髓移植要便宜,在美國如果患者在接受治療一個月後沒有好轉(僅限白血病適應症患者),則不會收取治療費(Outcome-based contracts,OBCs)。

圖2 Novartis生產的Kymriah
Kymriah適用日本醫保有以下要求,採用該療法必須滿足以下三個條件:
首先,該藥物的治療對象僅侷限於白血病和淋巴瘤中的特定部分群體:(1)患「B細胞性急性淋巴細胞芽球性白血病(B-ALL)或(2)「瀰漫性大細胞型B細胞淋巴腫」這兩種疾病的患者;其次,對於(1)還有25歲以下的年齡限制;第三,必須是在其他抗癌藥物無效的前提下。
日本厚生勞動省估計,日本國内目前同時滿足上述三個條件的患者數最多一年216人,市場需求規模約為72億日元。根據諾華製藥公佈的資料顯示,2018年Kymriah全球銷售額僅為7600萬美金(約83億日元),勉強達到諮詢機構Evaluate Pharma預測的2018年1.59億美元銷售額的50%,並未擠進諾華主打藥品的前20名。這也從另一個角度給進入CAR-T細胞治療風口的投資者一個警示,拋開技術問題不談,真正的潛在市場有多大也需要再確認。
2017年8月,美國食品藥品監督管理局(Food and Drug Administration,FDA)批准全球首款基於基因改造的商業化免疫細胞療法—Kymriah(CTL019)上市,適應於25歲以下和青年群體B細胞急性淋巴細胞白血病 (acute lymphoblastic leukemia, ALL);2018年5月,FDA批准Kymriah用於治療瀰漫性大B-細胞淋巴瘤(DLBCL)、高分化B-細胞淋巴瘤(high grade B-cell lymphoma),以及由轉化濾泡性淋巴瘤引起的瀰漫性大B-細胞淋巴瘤。2019年3月,Kymriah療法在日本通過了厚生勞動省的審批。
在日本的治療過程如下:醫院首先會將從患者身上抽取的白血球血樣進行先期處理,分離出T細胞然後冷凍保存運輸到諾華位於美國新澤西州的工廠。在諾華實驗室,患者T細胞經過體外基因改造,在細胞表面大量表達嵌合抗原受體(Chimeric antigen receptor, CARs),從而具備幫助T-細胞識別、攻擊人體內表面具有獨特性抗原CD19癌細胞的功能。基因改造後的T細胞體外擴增培養後製成商品製劑Kymriah。藥劑然後被運回日本醫院,再回輸到患者體內(圖3)。一個點滴療程即完成治療,前後約需要2個月。目前國立癌症研發中心醫院、九州大學附屬醫院、北海道大學附屬醫院、京都大學附屬醫院以及名古屋大學附屬醫院等都在積極準備引入該新療法。
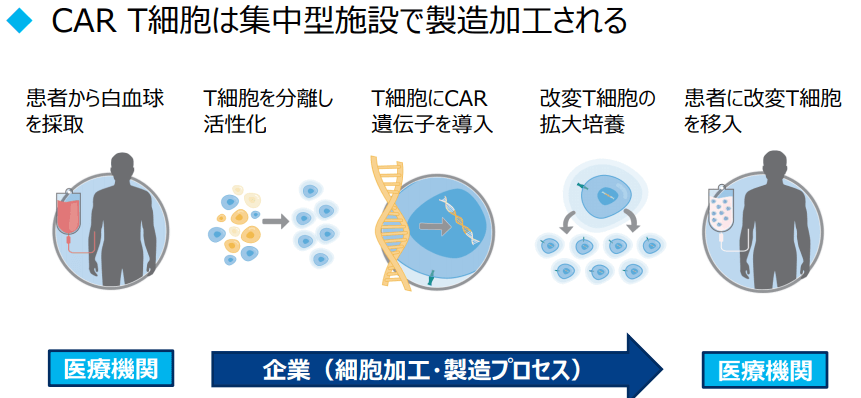
圖3 CAR-T 細胞療法基本流程
日本厚生勞動省決定將這款一個療程高達約3350萬日元的藥物適用於醫保,對患者來說無疑是件大好事。如此一來,用藥一次個人負擔大約控制在41萬日元左右(按照收入略有不同)。按照日本基本醫療保險的一般原則,患者隻需要付藥費的10-30%。根據《高額療養費制度》,根據年齡和收入不同,患者負擔部分也會設置上限。
但是,宏觀上隨著少子老齡化加劇,如果今後基本醫療保險仍然持續適用於單價較高的醫藥品,醫療保險財政狀況勢必更加嚴峻。健康保險組合聯合會的幸野莊司理事首先對政府的決定給予了積極肯定的評價,同時也提議根據醫藥品的重要程度更改報銷範圍和報銷比率。
諾華藥品的高價和日本政府最終的決定,也在網路和各大電視臺媒體掀起巨大反響。也有獲贊較多的網民留言,「100個人各報3000萬和1000萬人各報300日元是一回事。明明藥妝店裏花300日元就能買到的胃藥、軟藥膏,因為想走醫保非要到醫生那開藥方。與其批判高額醫藥,倒不如把這類可以在藥妝店買得到的藥品從醫保名單裏去除。不用軟藥膏不會死人,但新藥對白血病患者來說就是他的命。」
CAR-T細胞療法目前主要集中在白血病、淋巴瘤以及多發性骨髓瘤等,對實體瘤還無能為力。除了適應症的侷限性以外,包括Kymriah在内的目前所有CAR-T細胞療法面臨一些重大副作用的挑戰。
接受Kymriah治療後,80%的白血病患者和60%的淋巴瘤患者經歷了細胞介素風暴(Cytokine release syndrome, CRS, 細胞介素釋放症候群),即CAR T細胞激活大量細胞介素的釋放而引起類似感冒且伴有高燒或發冷、低血壓、呼吸耗竭、意識混亂、幻覺等症狀;20%白血病患者出現原因不明的神經性障礙,頭疼、震顫、昏睡、失語症、重度腦水腫等。
2017年9月,在上海長征醫院接受傳奇生物CAR-T療法的患者由於發生細胞介素風暴而死亡;2017年11月,一名白血病患者在接受蘇州佰通生物CAR-NK免疫細胞治療後死亡;2018年6月,中國首個CAR-T療法致死引發的訴訟在徐州市開庭[2]。
供稿 宋傑 東京大學博士
編輯修改 JST客觀日本編輯部













