東京大學生產技術研究所池内與志穗準教授的研究組,利用人工誘導多功能幹細胞(iPS cells)體外重建了軸突束連結大腦兩個遠端區域的結構(圖1),成功仿製了人工大腦組織[1]。該成果已經線上發表於2019年4月19日的《iScience》上[文獻1]。
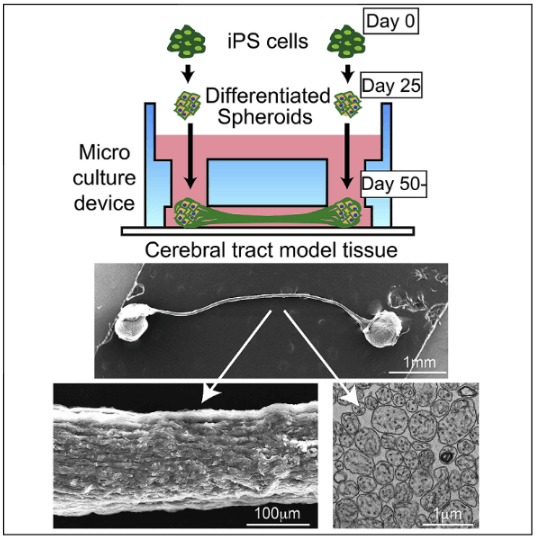
圖1 iPS細胞製成神經組織
人類的大腦皮層(cortex)根據功能的不同,被分成運動控制、視覺處理、語言處理等多個不同區域(圖2)。皮層主要是由神經元的細胞體、神經膠細胞、微血管等組成,顏色較深,又被稱為灰質(gray matter)。皮層下方髓質部分主要是神經元軸突組成的束狀組織,軸突外報備的髓鞘顏色較淺,所以髓質又被稱為白質(white matter)。皮層上空間分離的各功能區域間的信號處理,全有賴於白質束狀組織的介導統合。但是,束狀組織内的軸突布線異常複雜。為了研究腦内迴路和解析大腦工作機制,亟需搭建一個簡化的實驗模型體系。
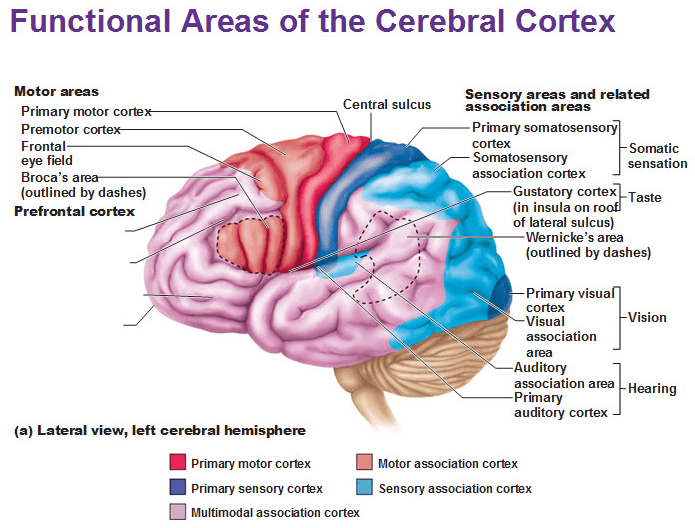
圖2 大腦白質不同功能區域劃分 (Antranik.org)
該研究團隊之前已經開發出在特製微裝置内通過培養運動聖經組織來高效製備束狀軸突組織的技術。在此基礎上,本次又成功製成了連結兩個人工大腦組織的束狀軸突組織。團隊首先利用約1萬個iPS細胞分化成球狀腦神經組織,在微裝置的兩端各放一個進行培養。該分化出的組織,既存在只有大腦神經才表達的獨特性蛋白,又呈現出腦神經發育中特有的構造,從而確認該分化組織為類腦神經組織。培養開始後,大多數神經細胞開始伸展出軸突;培養25日後,兩邊軸突通過微裝置中間狹長縫隙通道對接成功,形成由軸突束連結兩個人工大腦組織的體外腦神經模型(圖3)。

圖3 體外製備神經元軸突的微裝置
對人工腦神經連結部分進行免疫染色,觀察到神經軸突特有的標記性蛋白,同時未發現神經元細胞本體和樹狀突起等結構。利用電子顯微鏡觀察,束狀組織中軸突呈現出整齊劃一、非常規則的排列形式(圖4)。由此可說明,兩個遠端的人工腦神經組織自發地通過延伸軸突形成束狀軸突組織進行了連結交流。
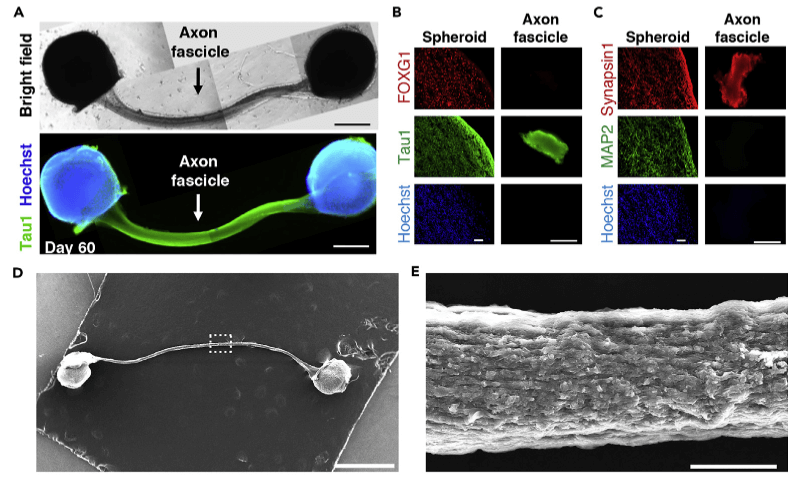
圖4 人工腦神經軸突束
另外,如果僅在微裝置的一側放置誘導後的球狀人工腦神經組織進行培養,另一側空置或者放置對照性玻璃球,軸突的延展效率都會較兩邊同時放置球狀人工腦神經組織時大打折扣,並且很難自發凝整合束。如果不使用微裝置,而是把球狀人工腦神經組織放置在不受空間約束的培養皿中培養,軸突可以向任一方向伸展而根本不會形成束狀軸突組織。以上觀察可以推測,兩個人工腦神經組織間在軸突延伸過程中存在促進性的相輔作用。
利用鈣成像技術進行電生理實驗,當一個球狀結構被電刺激後,另一個球狀結構也能檢測到信號,說明二者之間進行了資訊交換。而且軸突束另一端的球狀結構,比直接受到電刺激的球狀結構反應晚數十毫秒,該人工腦神經組織可視作大腦兩個遠端區域間資訊傳遞的模型(圖5)。
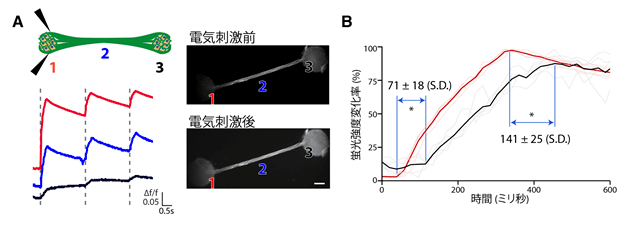
圖5 對人工神經組織利用鈣成像法進行電生理實驗
接下來,該團隊還研究了基因對模型軸突束形成的作用。已知L1CAM基因在正常機體軸突束的形成中有著不可或缺的地位。一旦L1CAM變異,會導致大腦内最大的白質帶-連接左右兩個大腦半球的胼胝體(Corpus callosum)-缺損。研究團隊利用敲出LICAM基因的iPS細胞進行人工神經組織實驗時發現,形成軸突束的效率也起伏同步大幅降低(圖6)。說明該模型不僅可用於模擬人體大腦神經組織發育過程,而且還可以用於構建中樞神經系統疾病模型。
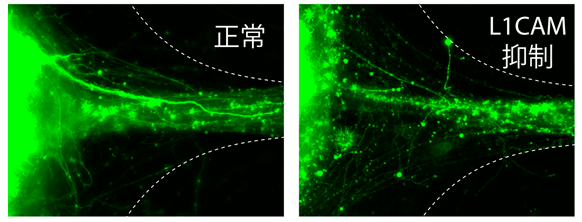
圖6 L1CAM基因剔除對人工軸突形成的影響
供稿 宋傑 東京大學博士
編輯修改 JST客觀日本編輯部
相關文獻:
1.Takaaki Kirihara, Zhongyue Luo, Siu Yu A. Chow, Ryuji Misawa, Jiro Kawada, Shinsuke Shibata, Farad Khoyratee, Carole Anne Vollette, Valentine Volz, Timothée Levi, Teruo Fujii, Yoshiho Ikeuchi. A human iPS cell-derived tissue model of a cerebral tract connecting two cortical regions. iScience. DOI:10.1016/j.isci.2019.03.012
相關鏈結:
1.東京大學新聞稿













