日本理化學研究所(簡稱「理研」)的研究小組發現名為「CAPON」的蛋白質與阿茲海默症的病情惡化有關。利用此次的研究成果,今後如能開發出新的抑制CAPON功能的藥物或方法,就有望控制阿茲海默症情的發展。
關於阿茲海默症的發病機製,目前普遍身份鑑定的解釋是「澱粉樣蛋白級聯假說」,即由於β-澱粉樣蛋白肽(Aβ)沉積物(澱粉樣蛋白病理),導致聚集了Tau蛋白的神經原纖維纏結(Tau病理),最終造成神經細胞死亡。不過,此前一直不清楚從澱粉樣蛋白病理到Tau病理及神經細胞死亡的轉變機制。
此次,研究小組通過進行相輔作用(Interactome)解析,發現CAPON會與Tau蛋白結合。另外還確認,在再現了人澱粉樣蛋白病理的模型小鼠腦内強製表達CAPON的話,會加劇Tau病理及伴有神經細胞死亡的腦萎縮,反之,使再現了Tau病理和神經細胞死亡的模型小鼠缺少CAPON基因的話,能抑制腦萎縮。因此,可以認為CAPON是在澱粉樣蛋白病理下誘導Tau病理和神經細胞死亡的重要因子。
相關研究成果已發布在英國線上科學雜誌《自然通訊》(6月3日)上。
研究小組為調查與Tau病理形成有關的蛋白質,首先進行了相輔作用解析,發現名為CAPON(C-terminal PDZ ligand of nNOS)的蛋白質會與Tau蛋白結合。雖然以前就知道CAPON會與nNOS(神經元型一氧化氮合酶)結合,在NMDA(N-甲基-D-天門冬胺酸)接受者的介導下引發興奮性毒性等,但一直不清楚其在阿茲海默症中發揮的作用。
研究小組此次在再現澱粉樣蛋白病理的AppNL-G-F基因敲入(KI)小鼠腦内分析了CAPON的表達情況,發現CAPON聚積在海馬體的錐體細胞層。另有報告顯示,阿茲海默症患者的腦内也存在相同的現象,因此在澱粉樣蛋白病理下,CAPON在海馬體內的聚積被認為影響了之後的阿茲海默症病理。
接下來,研究小組製作了以與人腦相同的式樣表單達Tau蛋白的MAPT KI小鼠。然後,使AppNL-G-F KI小鼠與MAPT KI小鼠交配,獲得雙KI小鼠,並利用腺相關病毒載體使CAPON在雙KI小鼠體內過表達。試驗結果發現,小鼠出現了Tau病理和神經細胞死亡,海馬體萎縮(圖1)。
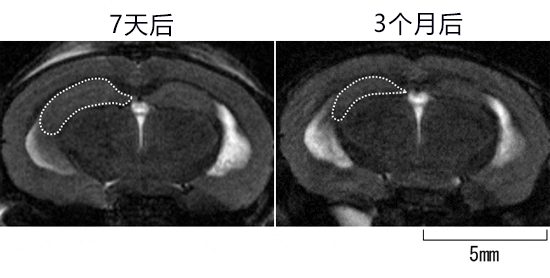
圖1:CAPON過表達小鼠的大腦MRI圖像
利用腺相關病毒使CAPON基因在AppNL-G-F KI和MAPT KI的雙基因敲入小鼠體內過表達,7天后和3個月後拍攝了MRI圖像。從圖像中發現,使CAPON過表達3個月後,海馬體明顯萎縮。
另外,研究小組還調查了誘導神經細胞死亡的機制,發現不僅是表示細胞程序性死亡的程式性細胞死亡標誌物,表示細胞發炎性死亡的細胞焦亡標誌物也增加。因此,可以認為是經過複雜的機制、而非單一路徑誘導了神經細胞死亡。
此外,研究小組從再現了Tau病理和神經細胞死亡的P301S-Tau轉基因小鼠(P301S-Tau-Tg)體內敲除(缺損)CAPON基因後,發現抑制了腦萎縮(圖2)。
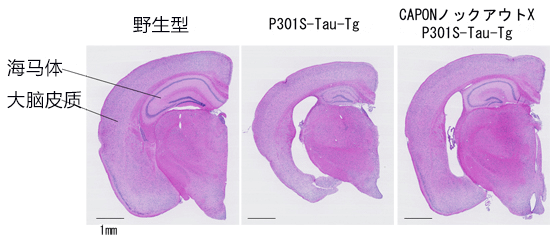
圖2:敲除了CAPON基因的X P301S-Tau-Tg小鼠的大腦
右側的圖像是CAPON基因剔除小鼠與P301S-Tau-Tg小鼠交配後誕下的小鼠的腦剖切(H&E染色圖像)。從圖中可以看出,P301S-Tau-Tg小鼠(中間的圖像)出現的腦萎縮現象通過使CAPON缺損得到了明顯抑制。另外,在右側圖像中還可以看出,神經細胞死亡發白的部分減少,海馬體和大腦皮質的尺寸及厚度也沒有像中間的圖像那樣縮小。
根據以上結果,可以認為CAPON是在澱粉樣蛋白病理下誘導Tau病理和神經細胞死亡的重要因素。
(日文全文)
文:JST客觀日本編輯部