【研究摘要】
蠍毒中的Agitoxin-2 (AgTx2) [1] 是鉀離子K+通道的有效阻斷劑。來自金澤大學的角野 歩博士和炭竈享司博士等使用高速原子力顯微鏡觀察了AgTx2與KcsA [2]通道結合的動力學過程。通過原子力顯微鏡影像分析單分子動力學可知,通道對AgTx2的親合力在持續的結合期間增加,在持續的解離期間降低。該研究提出了一種用來解釋該現象的四態模型,並且表明誘導契合 [3] 途徑主導著該現象並使結合速度提高了400倍。
【研究背景】
細胞膜中含有多條離子通道,調節著各種離子在細胞内部和外部之間的滲透。離子通道由蛋白質構成,能夠對不同的刺激產生響應,並只允許特定離子的滲透。通過這種方式,細胞可以調節電信號,而這些電信號正是形成肌肉和神經系統功能的基礎。相應地,離子通道的故障也是許多疾病的起因,例如心肌梗塞和癲癇,因此對阻礙離子通道功能的分子的作用機制的理解是十分重要的。
目前已發現蠍毒中含有超過200種與鉀離子通道結合的化合物。其中,AgTx2這種肽 [4] 由38個胺基酸殘基組成。先前的研究表明,通過與細胞膜外部的鉀離子通道結合,AgTx2可以封鎖鉀離子通道孔並抑制鉀離子的滲透。然而,分子層面的詳細機制仍然是未知的,例如,結合的動力學過程是否可用結合/解離兩態模型來解釋。
【研究成果】
該研究團隊使用高速原子力顯微鏡 (HS-AFM) [5] ,將AgTx2與鉀離子通道KcsA的結合和解離進行了視覺化,並對動力學進行了詳細分析(圖1)。 KcsA是一種四聚體,其構成單元成環狀結構排布。當AgTx2與該四聚體表面結合時,通道的中心部分,即鉀離子通路,由於AgTx2結合而出現隆起。 AgTx2與鉀離子通道的結合和解離可以反復進行,並且通道中心周圍的高度也相應地發生改變(圖2)。當溶液中的AgTx2濃度高時,結合機率也很高。結合和解離時的過程表明,當AgTx2與KcsA結合時,KcsA的構形發生變化,這使得AgTx2更容易與其結合,即使AgTx2解離,另一個AgTx2分子也可以很快地與KcsA結合。這被稱為誘導契合機制。
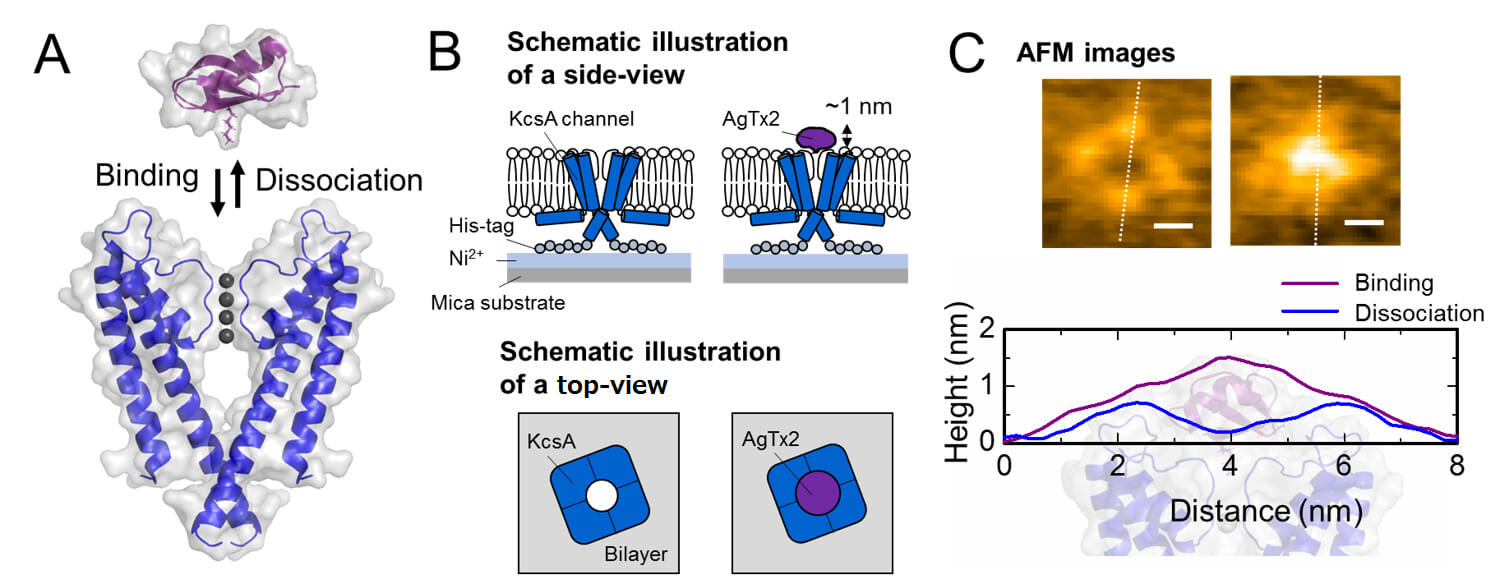
圖1. 鉀通道KcsA (Q58A / T61S / R64D) 和AgTx2結合和解離的示意圖與其AFM圖像。
A. KcsA和AgTx2的結合
B. 如何用AFM觀察樣品的示意圖
C. 具有代表性的AFM圖像
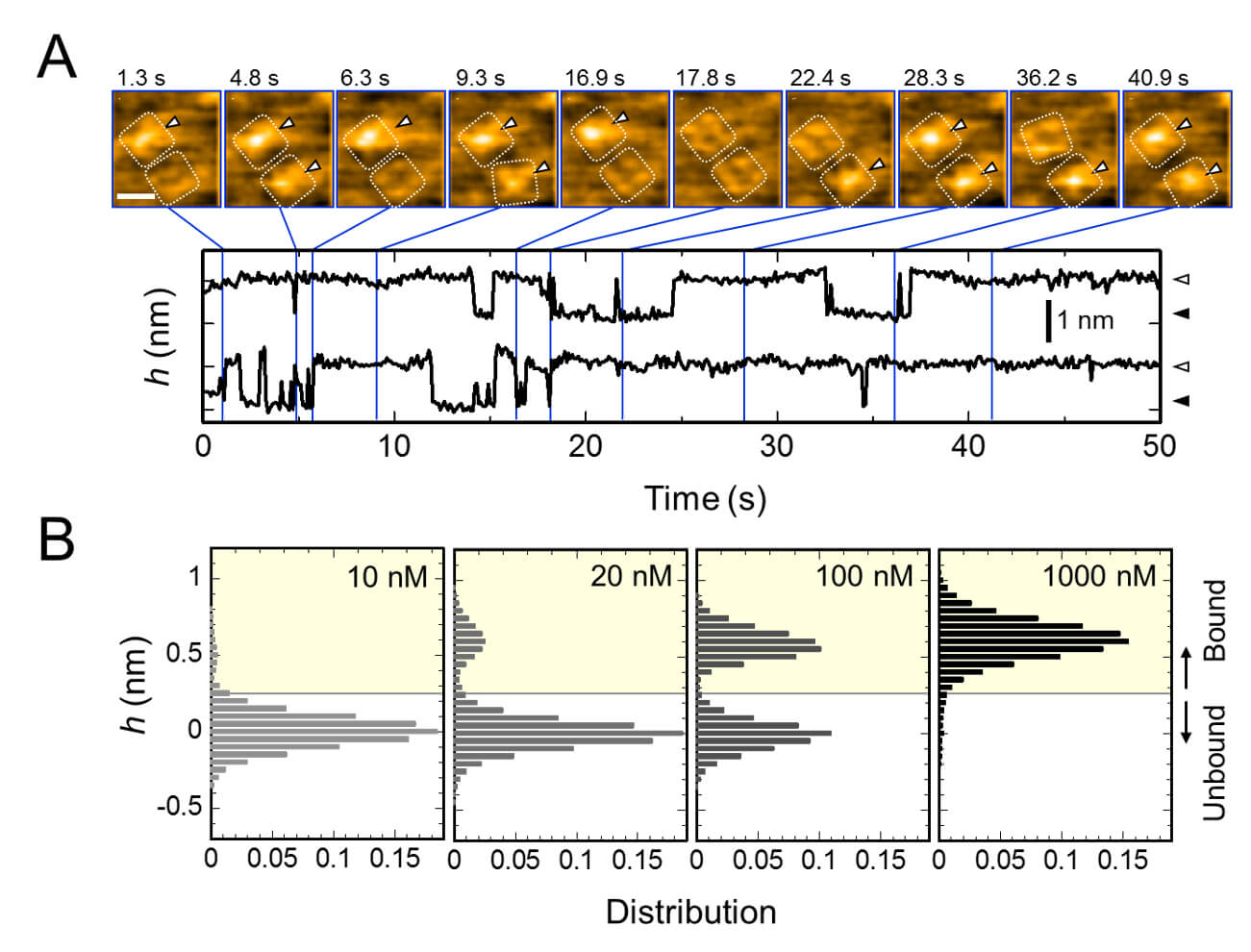
圖2. AgTx2與鉀通道KcsA的反復結合,以及結合機率-濃度關係圖
A. AgTx2與KcsA通道結合和解離的延時圖像以及細胞外表面中心周圍的平均高度隨時間的演變
B. 不同AgTx2濃度下的h高度直方圖
另一方面,該研究觀察到,當AgTx2解離後經過足夠的時間時,KcsA的構形變回其原始狀態,使AgTx2的結合變得不再那麼容易。這些結果說明,結合動力學不能用簡單的結合態/解離態這種兩態模型來解釋。KcsA的結合和解離狀態看上去都至少可以再區分為兩個子狀態,因此該研究考慮了四狀態關聯模型(圖3)。當從假設的四態模型計算反應速率時,發現其與通過實驗獲得的數據十分吻合。該團隊用這種四態模型和反應速率模擬了該反應的結合動力學,並揭示出AgTx2結合主要通過誘導契合途徑。進一步地,該團隊發現這種誘導契合機制使AgTx2結合加快了400倍。因此,AgTx2有效抑制KcsA功能的機制業已得到闡明(圖3)。
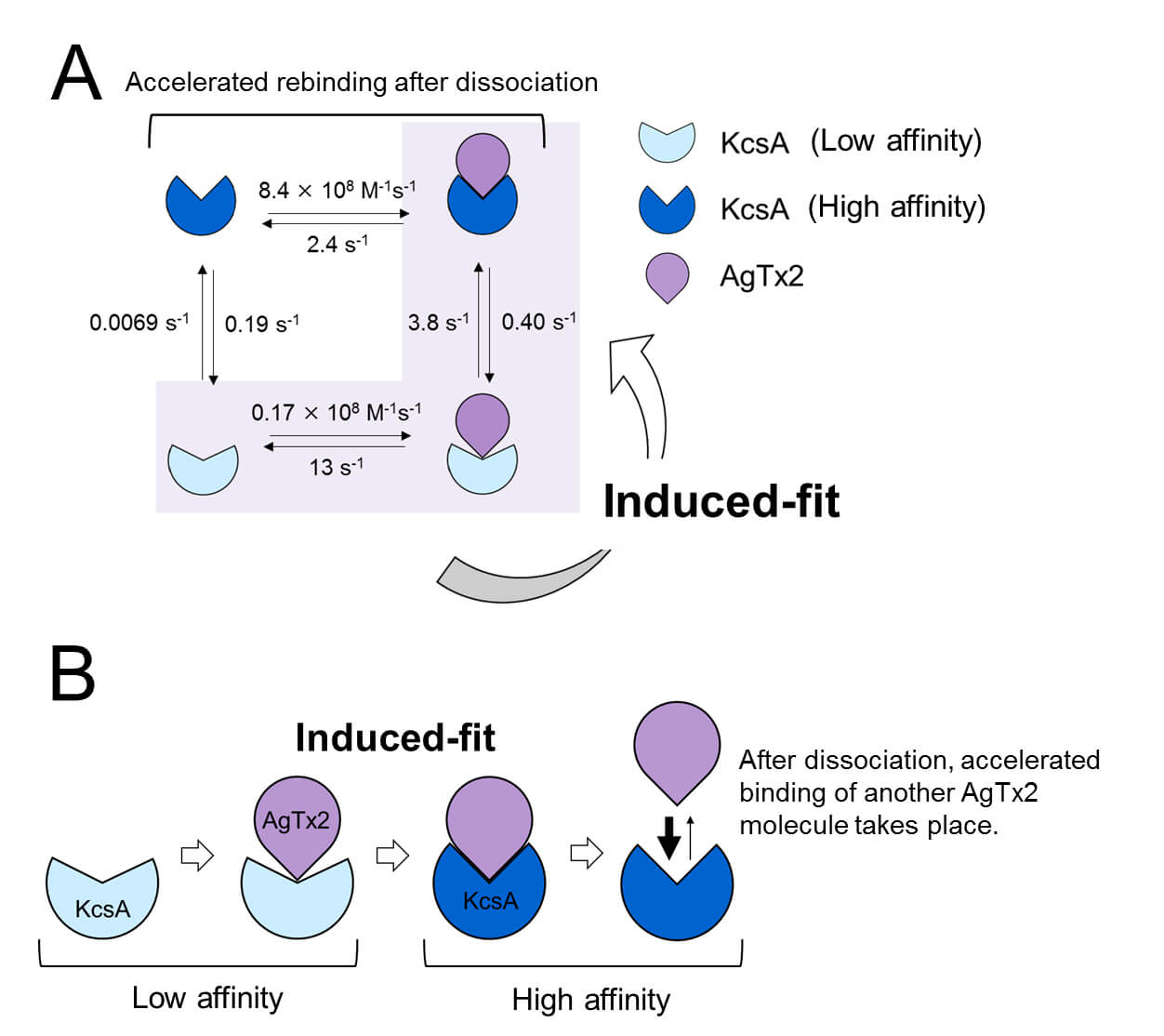
圖3.AgTx2和鉀通道KcsA結合的動力模式。
A. 反應步驟的速率常數。
B. 通過誘導契合機制加速的AgTx2與鉀通道KcsA的結合過程示意圖。
【研究前景】
這種用於分析鉀離子通道和肽抑制劑結合的高速原子力顯微鏡觀察技術和方法可以應用於多種生物分子。該方法也同樣適用於分析配體與其接受者相結合的過程以及DNA與DNA配對蛋白的結合過程。該方法對各種生物分子的結合動力學的理解都有著很大幫助,預計將有效加快相關研究進程,比如通道與相關配體的結合,DNA與其修飾蛋白的結合,抗原與其抗體的結合,這些結合現象無疑在生命科學和醫學應用領域中都佔有相當重要的地位。
注
[1] Agitoxin-2 (AgTx2):抑制鉀離子通道的蝎毒素 ,為肽類物質 ,與鉀通道毒素密切相關 。
[2] KcsA (K channel of streptomyces A): 就分子量而言是最小的鉀離子通道之一。當細胞内pH值變得低於正常值時,KcsA通道的門開啟,並允許鉀離子的高選擇性滲透。由於其晶體結構已知且穩定性高,因此被廣泛用作研究鉀離子通道的模型。
[3] 誘導契合:在分子與其接受者結合後,接受者的構形發生變化以誘導更緊密的結合。
[4] 肽:由2至50個胺基酸組成的化合物,通過肽鍵以線性方式連接。
[5] 高速原子力顯微鏡 (HS-AFM):原子力顯微鏡是用於以高解析度來觀察樣品表面的設備,該設備有一個尖銳的探針連接在懸臂上,然後用該探針來探測樣品的表面。本研究中用到的原子力顯微鏡具有高時間與空間解析度,所以被稱為高速原子力顯微鏡,由金澤大學開發。
(日文新聞發布全文)
文 JST 客觀日本編輯部翻譯整理














