敗血症是由體內發炎引起的嚴重疾病,目前尚無有效的藥物能徹底治癒。另外,病情發展速度非常快的惡性腦腫瘤「膠質母細胞瘤(GBM)」會對抗癌藥產生抗藥性,目前幾乎沒有有效的治療藥物。治療這些嚴重疾病的新藥的研發備受期待。
體內發生發炎時,免疫細胞和瀕死細胞會釋放名為HMGB1(高遷移率族蛋白B1)的核内染色質蛋白。這種HMGB1通過與名為RAGE(晚期糖基化終末產物接受者)的獨特性細胞膜接受者結合,在細胞内引起發炎過程。
東京理科大學的田沼靖一教授帶領的研究小組開發了以蛋白質間的相輔作用(PPI)為靶標的計算機模擬(In Silico)新藥研發法「COSMOS」,並通過HMGB1與RAGE的結合預測區域對新型環肽進行分子設計,發現其具有RAGE抑制活性。另外,通過進行肽結構相似解析發現,普通的解痙藥「罌粟鹼」能抑制HMGB1與RAGE結合,具有抗炎、抗癌等新藥效。研究小組利用模型動物進行實驗,確認罌粟鹼是能夠有效治療敗血症和膠質母細胞瘤等的藥物。
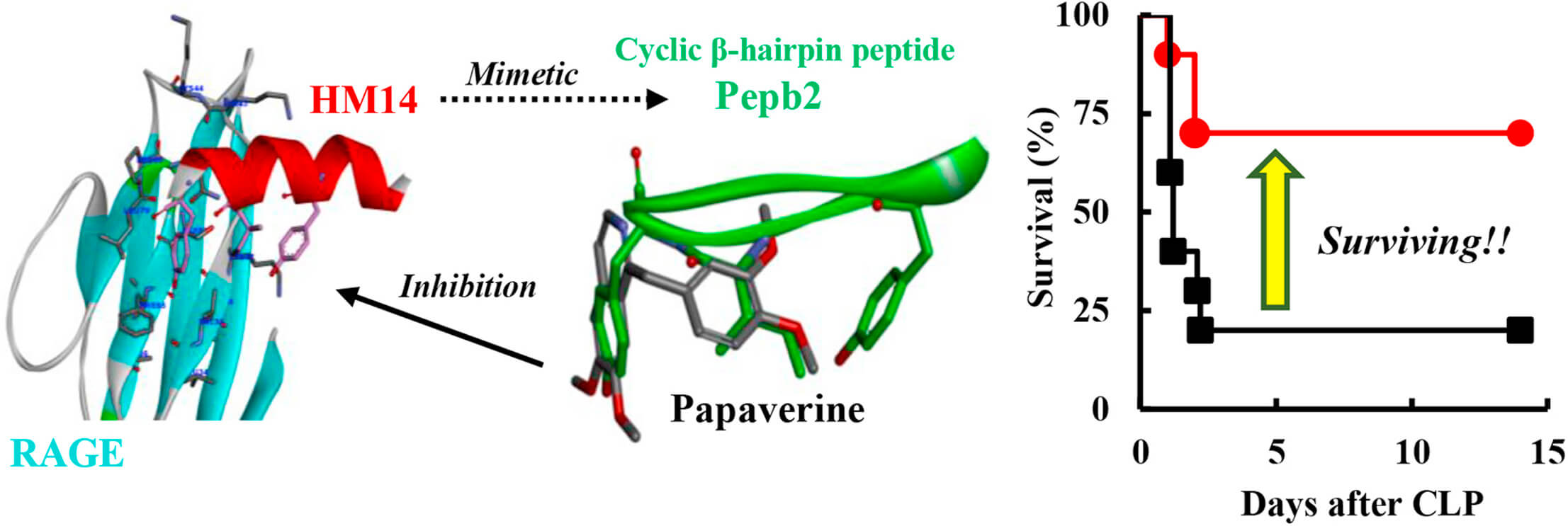
這種結合計算機技術的新藥研發方法和「藥物重定位」(Drug Repositioning)方法,有助於在安全性已經得到確認的現有藥物中發現尚未知曉的新藥效。有關論文已發表於《生物化學與生物物理可用能研究通訊》(Biochemical and Biophysical Research Communications),鏈結: https://www.sciencedirect.com/science/article/pii/S0006291X19301706?via%3Dihub 。
田沼教授表示:「研究小組通過查明程式性細胞死亡的控制機制,開發並嘗試以蛋白質間的相輔作用為靶標的In Silicon新藥研發法,製作了程式性細胞死亡控制化合物。希望製作出用於癌症和阿茲海默症等的治療藥物的先導化合物。」
研究重點
利用In Silicon新藥研發法發現,1848年發現的傳統血管擴張藥及解痙藥「罌粟鹼」,具有抗炎和抗癌作用等。
研究發現,罌粟鹼通過抑制受損細胞和免疫細胞釋放出來的信號分子(HMGB1)與控制發炎反應的細胞膜接受者蛋白(RAGE)結合,來抑制發炎反應,有望用來治療敗血症、癌症(膠質母細胞瘤)、阿茲海默症和糖尿病等由身體發炎引起的多種疾病。
利用這種方法進行「藥物重定位」,與開發全新的藥物相比,在時間、成本和安全性方面效率更高,可以擴大現有藥物的治療範圍,以及引領新藥開發。
(日文新聞發布全文)
文:JST客觀日本編輯部翻譯整理














