理化學研究所(理研)開拓研究中心田中生物機能合成化學研究室的田中克典首席研究員與Kenward Vong、江田昌平、Igor Nasibullin特聘研究員等組成的國際研究小組,通過過渡金屬催化反應令癌細胞「就地合成」具有抗癌活性的分子藥物,並成功達成了癌症治療效果[1]。
由於本研究中的抗癌藥物是在體內病灶部位原位催化合成,因此有望拓展為具有極小副作用的新一代癌症治療通用療法(圖1)。詳細研究内容已經線上發表於2019年7月1日的《Nature Catalysis》上[文獻1]。
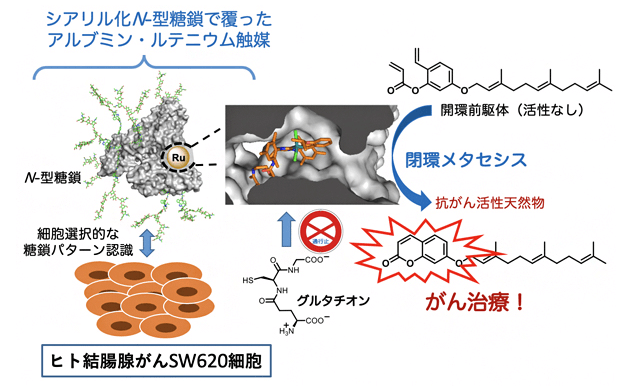
圖1 「就地合成」抗癌藥物的癌症療法
過渡金屬是指元素週期表中位於d區第3族到第11族的金屬元素,往往具有一些特殊的反應特性。烯烴複分解反應(Olefin metathesis)是由含鎳、鎢、釕和鉬等過渡金屬卡賓配合物催化的烯烴雙鍵重組反應,以其綠色環保高效的特性在醫藥和聚合體工業有著廣泛的應用。其發現先驅Yves Chauvin、Robert H. Grubbs和Richard R. Schrock更在2005獲頒諾貝爾化學獎。
近年,一些高效的過渡金屬卡賓配合物觸媒及人工金屬酶等被陸續開發出來。但目前為止,過渡金屬催化反應都是在能保證其無水及良好反應條件的燒瓶内完成。由於生物體內存在水、血清、蛋白質、糖類、酯類以及麩胱甘肽(Glutathione)等各種催化反應干擾分子,普遍認為想讓這些金屬觸媒不失活保證催化反應的正常進行是不可能的。
過去兩年間,田中首席研究員等成功生成了人工糖基化血清白蛋白-金觸媒錯合物。然後通過靜脈注射入小鼠體內,根據人工附加的識別信號糖鏈不同,錯合物分別被轉運到肝臟、腸道等不同目標部位並原位催化相關特定有機化學反應(Angewandte Chemie International Edition,2017; Chemistry – A European Journal, 2018)(圖2)。
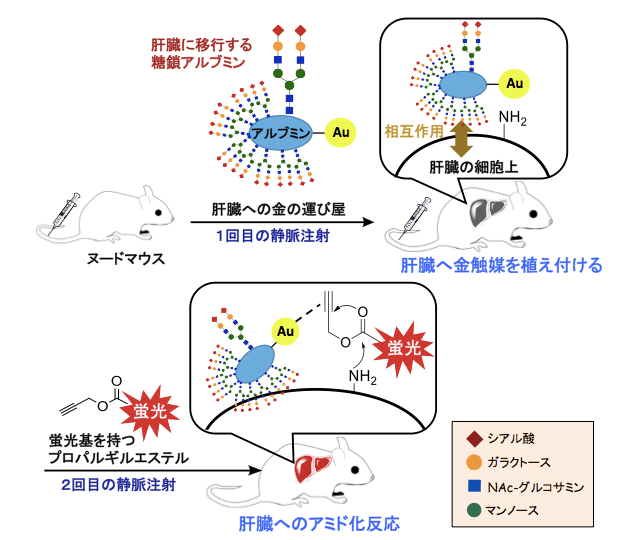
圖2 人工糖基化血清白蛋白-金觸媒錯合物定向轉運至小鼠肝臟
如果能在人體內特定器官或者病灶細胞内觸發過渡金屬催化反應,那麼就有可能實現在特定器官組織内現場快速合成靶向這些病灶部位的活性藥物,並且極大限制了由於脫靶造成的副作用。這樣一來,以往由於獨特性差難以定向發揮藥效而被無奈放棄的無數強抗癌候選藥物,以及在體內環境不穩定半衰期過短的候選藥物,都可以通過在病灶部位「就地合成」來精準、穩定地發揮藥效,重新作為候選藥物走進臨床。這種完全不同於以往化學藥物體外合成然後通過口服、注射等途徑體內投放的傳統施藥策略,直接在體內病灶部位通過有機化學反應合成藥物發揮藥效的新一代治療方案,必將引來醫藥領域的巨大變革。
已知生物體內尤其細胞主記憶體在大量的麩胱甘肽,可以絡合釕觸媒從而使後者失去催化活性。因此要在體內實現釕催化關環複分解反應非常困難。本次研究團隊通過向糖基化白蛋白的疏水性口袋結構中導入釕觸媒,由於親水性的麩胱甘肽無法進入疏水口袋結構内,成功觀察到了在機體内仍高效維持的關環複分解反應催化活性(圖3)。
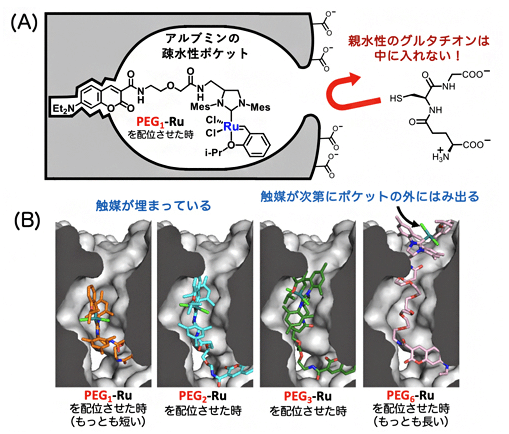
圖3 麩胱甘肽無法干擾疏水口袋内的釕催化反應
研究團隊進一步對能否在特定癌細胞内實現催化反應從而應用於癌症治療進行了模擬實驗。從天然植物中提取的Umbelliprenin(傘形花醚、傘形花內酯金合歡醚)對癌細胞有很強的細胞毒性,但對正常細胞也有很高的殺傷力。同時,Umbelliprenin的開環前驅物則對正常細胞和癌細胞都沒有太大毒性。團隊利用這個特點,有選擇性地將糖基化白蛋白-釕觸媒化合物導入人源癌細胞後,讓癌細胞自體將開環無毒性的藥物前驅物(Prodrug) 通過關環複分解反應 「就地合成」為具有強抗癌特效的Umbelliprenin,從而成功殺死癌細胞。
此次研究成功通過蛋白質疏水性口袋結構和過渡金屬觸媒形成錯合物的形式,提高了後者的水溶性及在體內環境下的穩定性,並實現了高效率的體內催化反應。研究團隊下一步會重點考察人工金屬酶在體內的安全性和受質獨特性。一旦突破臨床應用,「體內合成化學治療」時代無需開發新的藥物分子,此前各大醫藥企業放棄的候選新藥及目前使用受限的藥物等都將是無窮盡的新藥候選寶庫。
供稿 宋傑 東京大學博士
圖除特別註釋外均取自日文新聞發布稿
編輯修改 JST客觀日本編輯部
參考文獻:
1. Shohei Eda, Igor Nasibullin, Kenward Vong, Norio Kudo, Minoru Yoshida, Almira Kurbangalieva and Katsunori Tanaka, "Biocompatibility and Therapeutic Potential of Glycosylated Albumin Artificial Metalloenzymes", Nature Catalysis, 10.1038/s41929-019-0317-4
相關鏈結:
1. 理研新聞發布稿













