熊本大學發生醫學研究所谷川俊祐助教和西中村隆一教授等的研究組,成功開發出體外快速擴增人源iPS細胞(人工誘導多功能幹細胞)由來的腎祖細胞的技術(圖1)[1]。該研究成果已經線上發表於2019年8月1日的《Stem Cell Reports》上[文獻1]。
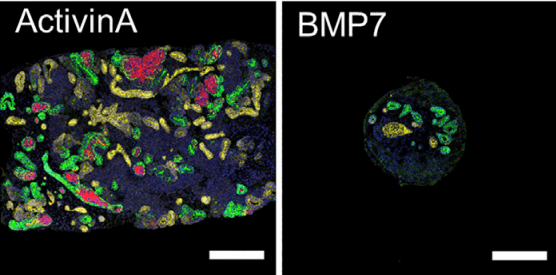
圖1 添加激活素Activin後實現腎祖細胞體外快速擴增
與自我修復再生能力超強的肝臟不同,作為生成尿液和調節血壓等維持生命所必須的腎臟一旦機能失落發生腎耗竭就無法再生。腎臟内製造尿液的基本功能組織單元—腎單位(Nephron,又稱腎元,包括腎小球和腎小管等)是在胎兒時期由腎祖細胞發育而來。但是在人體腎臟完全發育成熟的出生前,腎祖細胞就會消失不見,這也是腎臟無法自體再生的原因之一。
西中村隆一教授等研究團隊2014年就已經報告了通過人源iPS細胞誘導生成腎祖細胞的方法。而後在2016年,將iPS細胞誘導生成的腎祖細胞移植到實驗小鼠體內後,驗證發現腎祖細胞成功發育成熟為腎小球的足細胞(Podocytes)。足細胞又稱為腎小囊髒層上皮細胞(visceral epithelial cell),是位於鮑氏囊上環繞腎小球微血管的章魚狀細胞(圖2),足細胞細胞本體延伸出的突出部分稱為足突或足梗(pedicel)。足細胞病灶可伴隨蛋白尿的產生,例如新生兒芬蘭型先天性腎病症候群。該類症候群患者,由於腎小球異常導致血液中的蛋白質洩漏到尿液中,在出生後3個月内即可發生嚴重蛋白尿。同時因為血液中蛋白質的濃度降低而引起全身性水腫,通常在2至3年内會快速導致腎耗竭的發生。
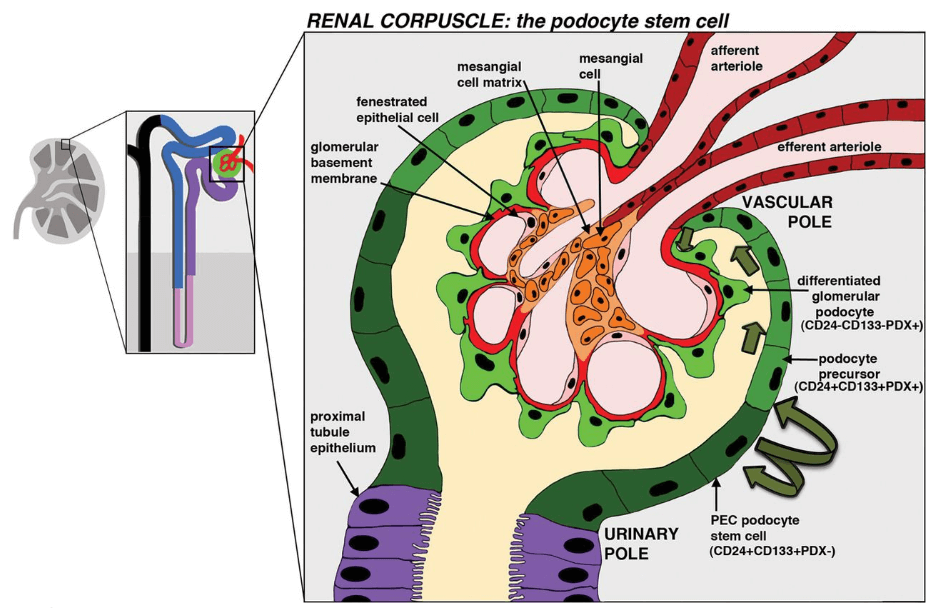
圖2 腎臟、腎單位與足細胞示意圖(圖/《Biochemical Journal》)
2018年,研究團隊利用先天性腎病症候群患者由來的iPS細胞誘導成的腎祖細胞體外重現了新生兒腎臟病的初期表現狀態。沿著這個思路,後續無論是應用於再生醫療還是用於新藥研發,都需要建立一套體外大量擴增腎祖細胞的方法。2016年穀川助教等人曾將從實驗小鼠的鼠胎中分離到的腎祖細胞成功實現了體外擴增。其他研究團隊也有關於從小鼠或人類胎兒分離培養腎祖細胞的報導,但人源iPS細胞由來的腎祖細胞擴增以及冷凍保存等一直沒有進展。
本次,研究團隊意外發現用激活素(Activin)替代原本通用的添加因子---骨形成蛋白(bone morphogenetic protein,BMP)後,可以有效實現體外快速擴增人源iPS細胞由來的腎祖細胞(圖3)。激活素,又稱為激活蛋白或者活化素,與功能相反的抑制素(Inhibin)以及骨形成蛋白都屬於轉化成長因子(TGF)β超級家族的一員,於1986年首次從豬卵室液中被鑑定。激活素為細胞間信號傳遞分子,能夠刺激腦垂腺前葉腺細胞促性腺激素(FSH)的分泌,並在脊椎動物初期胚胎形成、細胞增殖分化和凋亡、代謝和體內平衡、免疫應答、傷口癒合、內分泌、血管平滑肌增殖、動脈硬化、神經分化誘導等多個生物功能場景中發揮作用。
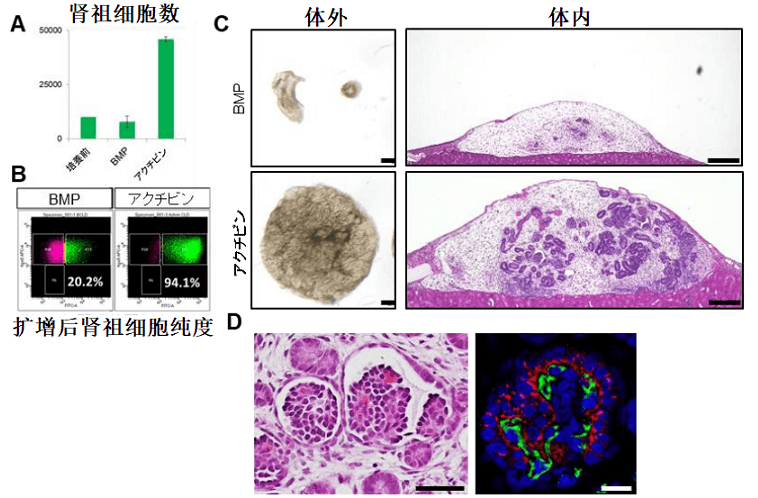
圖3 腎祖細胞擴增時激活素明顯優於骨形成蛋白
研究團隊發現,添加激活素後腎祖細胞一星期内即擴增了5倍,純度保持在90%以上。並且擴增後的腎祖細胞可以進行長期冷凍保存,解凍後依然保持生成腎臟組織的能力(圖4)。如此一來,臨床上或其他相關研究機構可以跳過從人源iPS細胞向腎祖細胞的費時費力的前期繁瑣操作過程,而且那些未曾處理過iPS細胞誘導實驗的研究室也不必從頭學習和建立平台即可直接開展下游工作。
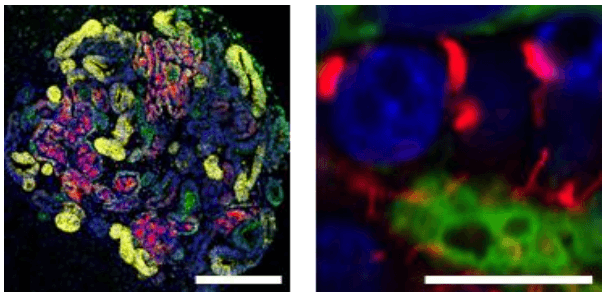
圖4 利用解凍後的腎祖細胞分化出的腎臟組織
由於腎臟屬於傷害後無法自我修復的「一次性」器官,隨著目前透析患者和等候腎移植患者數目的不斷攀升,亟需拓展新的治療思路和方法。本次研究發現,從iPS細胞誘導製備出腎祖細胞,保證向腎臟組織的分化能力同時實現擴大培養,並且能夠通過冷凍保存運輸(圖5)。由此一來,通過患者細胞得到的iPS細胞即可分化成熟為腎臟組織進而用於揭示發病機理和新藥開發等,另外通過類似手法也可以用於腎臟組織的再生醫療。
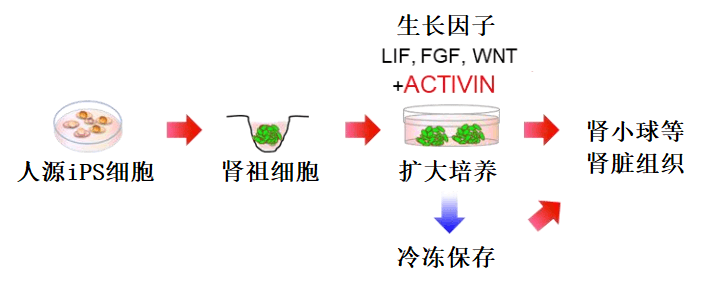
圖5 本次實驗技術路線圖
供稿 宋傑 東京大學博士
圖除特別註釋外均取自日文新聞發布稿
編輯修改 JST客觀日本編輯部
相關文獻:
1. Shunsuke Tanigawa, Hidekazu Naganuma, Yusuke Kaku, Takumi Era, Tetsushi Sakuma, Takashi Yamamoto, Atsuhiro Taguchi, and Ryuichi Nishinakamura. Activin is superior to BMP7 for efficient maintenance of human iPSC-derived nephron progenitors. Stem Cell Reports. doi:org/10.1016/j.stemcr.2019.07.003
相關鏈結:
1. 熊本大學官方新聞稿













