日本東京大學的一個研究小組利用將Cpf1蛋白一分為二獲得的分割體(Split-Cpf1),成功開發出了可通過光來控制基因體(基因)編輯、或者更有效地表達基因的工具。
近年來的研究顯示,CRISPR-Cpf1對靶DNA的獨特性要高於以往技術CRISPR-Cas9,因此有望成為脫靶效應小的高精度基因體工程技術。不過,由於Cpf1的分子結構與Cas9大不相同,存在以Cas9為基礎開發的技術無法直接應用於Cpf1的問題。本研究為解決這個問題,通過分割Cpf1開發出了Split-Cpf1,通過光刺激實現了高精度基因體編輯和效率非常高的基因表現控制。今後有望以Split-Cpf1為基礎,進一步推進生物基因體工程的發展。
相關研究論文發表在8月12日的《自然-化學生物學》(Nature Chemical Biology)網路版上。
研究小組此次著眼於通過分割Cas9便可利用化合物或光刺激誘導基因體編輯的性質,首先在不同的位置將Cpf1一分為二。獲得的34種分割體(Split-Cpf1)中包含N末端片段與C末端片段無法直接締合的分割體。分割的Split-Cpf1的N末端片段與C末端片段如果不締合,就無法與靶基因結合,因此要從外部誘導締合。通過在這種「誘導型Split-Cpf1」上連接該研究小組開發的光開關蛋白「Magnet系統」,開發出了可通過開啟或關閉藍色光,來誘導DNA切割活性開啟或關閉的光激活型Cpf1(paCpf1)(圖1)。
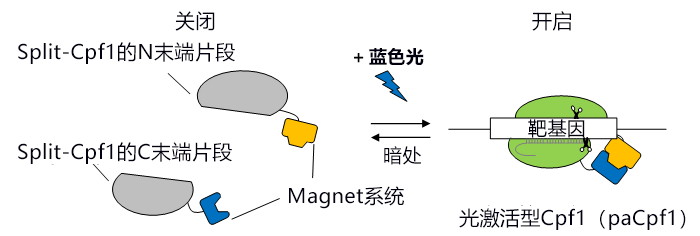
圖1:此次開發的光激活型Cpf1(paCpf1)的模式圖
此次研究小組發現,分割Cpf1獲得的Split-Cpf1中除了上述「誘導型Split-Cpf1」外,還包含N末端片段與C末端片段會自然締合工作的「自發締模具組裝Split-Cpf1」。研究小組在此前的研究中就發現了Cas9的「誘導型」分割體(Split-Cas9),但在CRISPR系統中,作為「自發締模具組裝」分割體,此次的「自發締模具組裝Split-Cpf1」還是首次在細胞内表現出高DNA切割活性。
研究小組利用「自發締模具組裝Split-Cpf1」,開發出了能以非常高的效率激活基因表現的技術。「自發締模具組裝Split-Cpf1」除了Cpf1原本具備的N末端和C末端外,還存在分割後新生成的N末端和C末端。研究小組導入了使Split-Cpf1失落DNA切割活性的突變(稱為「Split-dCpf1」),並在Split-dCpf1的全部4個末端連接轉錄激活因子和核定位訊息序列,由此開發出了基因表現激活技術「dCpf1-SA2.0」(圖2)。研究小組以培養細胞中的内源基因表現為指標對該技術進行評估發現,「dCpf1-SA2.0」能以遠遠高於以往的CRISPR–Cas9技術的效率激活基因表現。
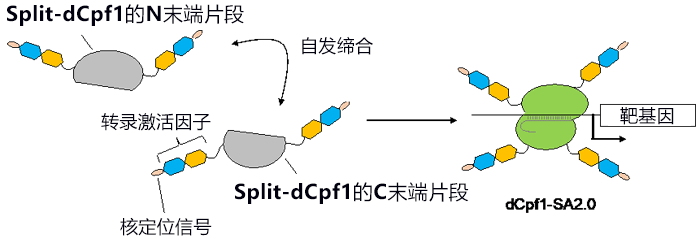
圖2:本次研究開發的自發締模具組裝Cpf1(dCpf1-SA2.0)
此外,研究小組還證明,「dCpf1-SA2.0」在小鼠體內能有效激活基因表現。向小鼠的肝臟導入「dCpf1-SA2.0」後發現,肝臟中有效表達了螢光酵素的蛋白質(圖3a、b)。而在採用dCpf1的現有技術(dCpf1-VPR)下,幾乎觀察不到螢光酵素的表達(圖3a、b)。另外,以内源基因表現為指標實施的評估顯示,「dCpf1-SA2.0」能在小鼠體內非常強烈地激活了相應基因的表達(圖3c)。
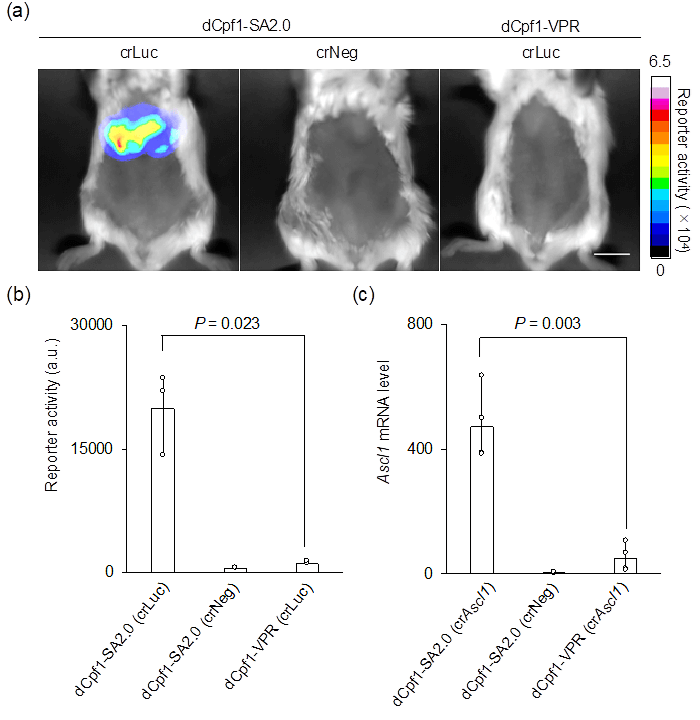
圖3:螢光酵素報告基因在小鼠肝臟中的反應
文:JST客觀日本編輯部翻譯整理














