東京大學藥學院有機和藥物化學研究室翟璐晗特聘研究員及大和田智彥教授、尾谷優子講師一起,使用計算化學對被認為與阿爾茨海默氏症(Alzheimer’s Disease, 俗稱老年癡呆症)密切相關的β-澱粉樣蛋白(Amyloid β,Aβ)的聚集結構進行了拓撲分析(圖1),在其疏水核區域首次發現此前從未被科學界關注到的弱電子相輔作用,從而揭示了β-澱粉樣蛋白沉積物的起源[1]。相關研究成果已經發表在2019年7月24日的《Scientific Reports》上[文獻1]。
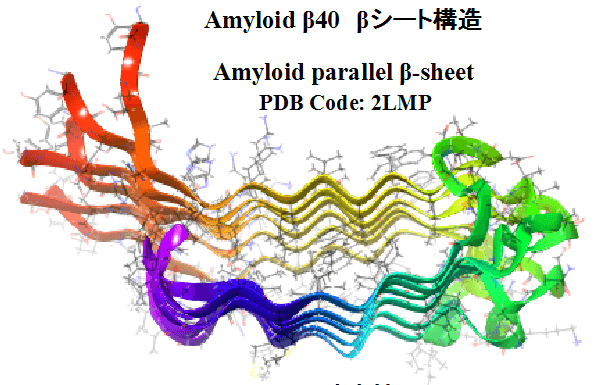
圖1 β-澱粉樣蛋白40 的β-摺疊結構示意
阿爾茨海默氏症最先由德國精神學家與病理學家Alois Alzheimer於1906年發現,是一種發病進程緩慢並隨著時間不斷惡化的神經退行性疾病,是失智症(癡呆症)的主要大類。2014-2015年間導致美國人十大死因中阿爾茨海默氏症排名第六,但增長趨勢遠超前五位並是排名第一位心臟病的17倍;在世界衛生組織(WHO)公佈的2016年全球前十位死亡原因中位列第五(圖2);2017年BBC報導全球前十名死亡原因中失智症(老年癡呆症)位於心血管疾病、癌症、呼吸系統疾病、糖尿病、下呼吸道感染之後,列第六位。目前在發達國家中,阿爾茨海默氏症被認為是耗費最多社會資源的一類疾病。
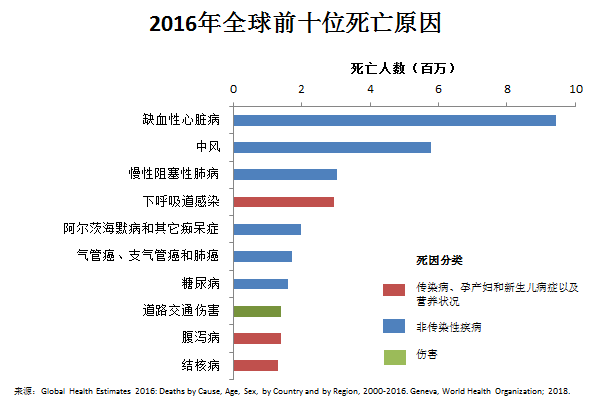
圖2 WHO官網公佈的2016年全球前十位死亡原因
雖然阿爾茨海默氏症被發現以來已逾百年,但其發病原因至今未有定論。其中佔主導的一個推測病因為1991年提出的β-澱粉樣蛋白假說。β-澱粉樣蛋白是澱粉樣前驅物蛋白( amyloid precursor protein,APP)被蛋白酶水解後產生的約39-43個胺基酸組成的短肽。β-澱粉樣蛋白在大腦中聚合堆積形成β-澱粉樣斑塊(β-amyloid plaques)沉積物是阿爾茨海默氏症的主要病理特徵之一,並被認為是主要發病原因。也有假說認為未形成斑塊沉積物的β澱粉樣蛋白寡聚體才是致病主謀,這些又被稱為澱粉樣蛋白衍生可溶性配體(amyloid-derived diffusible ligands, ADDLs),是類似傳染性蛋白顆粒蛋白(prion protein, PrP)的一種具有傳染性的蛋白質,會引起傳遞性的神經系統變性病。
β-澱粉樣蛋白因含有大量疏水性氨基酸而具備易於聚集堆積的特徵,這些聚集形式多是β-摺疊(β-sheet)結構(圖3)。β-摺疊又稱β片層結構(β-pleated sheet),屬於蛋白質典型的二級結構類型之一。β-摺疊中,兩條以上氨基酸鏈(肽鏈)或同一條肽鏈之間的不同部碎形成平行或反平行排列,一般認為是通過肽鏈間或肽段間的氫鍵維繫。這每一條肽鏈或肽段被稱為β-摺疊股或β-股(β-strand),氫鍵主要在股間而不是股内。
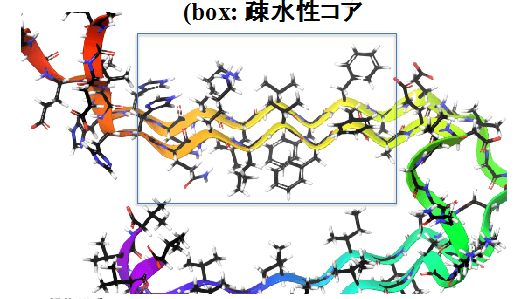
圖3 β-澱粉樣蛋白疏水性核區域的β-摺疊結構
本次研究小組通過QTAIM (Quantum Theory of Atoms in Molecules,分子中的原子量子論)對β-澱粉樣蛋白β-摺疊位相結構計算分析發現,β-股内空間接近的特定疏水性氨基酸原子間原本微不足道的電子會發生積聚,並最終形成弱電子相輔作用;進一步發現,β-澱粉樣蛋白的β-股間除了常規的氫鍵維繫外,也由於這些弱電子相輔作用的存在而形成更為牢固的網狀結構,最終促成β-片層的穩定存在(圖4)。
圖4 兩條β-股間弱電子相輔作用示意圖
本次發現β-澱粉樣蛋白肽鏈中疏水性氨基酸的側鏈之間存在的弱電子相輔作用,表明以往所認為的由整體相輔作用形成的蛋白間疏水性結構並非均質,而是依存於氨基酸成分中每個原子並且具有明確的方向性。本次對β-澱粉樣蛋白聚集結構的微觀電子行為分析,揭示了β-摺疊及斑塊沉積物的結構起源,將極大有助於針對阻止β-澱粉樣蛋白沉積物的新藥開發。
供稿 宋傑 東京大學博士
除特別標註外圖均取自日文新聞發布稿
編輯修改 JST客觀日本編輯部
參考文獻:
1.Luhan Zhai, Yuko Otani and Tomohiko Ohwada , "Uncovering the Networks of Topological Neighborhoods in β-Strand and Amyloid β-Sheet Structures," Scientific Reports: 2019.07.24, doi:10.1038/s41598-019-47151-2.
相關鏈結:
1.東京大學新聞發布稿