日本名古屋市立大學研究生院藥學研究科生命分子構造學領域的加藤晃一教授與大阪大學研究生院工學研究科的内山進教授,著眼於控制體內免疫功能的抗體分子及其接受者推進了聯合研究,並全球首次發現,除了此前確認的結合位置外還存在新的結合位置。相關研究成果已於8月16日發布在以自然科學和臨床科學的所有領域為對象的開放存取期刊《科學報告》(Scientific Reports)上。
研究成果的重點
細菌和病毒等異物侵入生物體內時,免疫功能會通過抗體發揮作用,滅絕這些異物。基於這種功能,抗體作為生物藥品得到了廣泛利用。抗體通過Fab部分擷取異物,通過Fc部分與免疫細胞中的Fc接受者結合。此前一直認為Fc接受者正如其名稱一樣,隻與抗體的Fc部分結合,但本次研究發現,除了抗體的Fc部分外,Fab部分也會與Fc接受者結合。這項研究成果將改寫免疫學教科書上描寫的「Fc接受者是抗體的Fc部分的接受者」這種說法,同時,還有望提高作為癌症等的分子靶向藥物使用的抗體藥物的功能,作為新藥開發的標靶也備受期待。
研究背景
我們的體內存在抵禦外部異物侵入的免疫功能。尤其是血液中大量存在的蛋白質——抗體,在獨特性識別細菌、病毒和癌細胞等之後,會與免疫細胞結合來激活免疫功能,滅絕這些異物。要想發揮這些功能,抗體必須與免疫細胞中存在的Fc接受者結合。
此前一直認為是抗體的Fc部分負責與Fc接受者結合,並利用以往的物理化學方法,明確了抗體的Fc部分與Fc接受者結合的情況。但之前的研究存在一個問題,即利用物理化學方法的研究環境與抗體在實際的生物體內發揮功能的環境大不相同。
治療癌症等使用的抗體藥物正是利用了抗體與免疫細胞結合介導的免疫功能,抗體與免疫細胞結合的強度直接關係到殺死異物的能力,因此這些分子的結合備受關注。
研究成果
本研究模擬了抗體實際工作的環境,並利用高速原子力顯微鏡,首次即時觀測到了抗體與Fc接受者結合的情形。另外,對結合強度進行計算發現,與抗體的Fc部分相比,包含Fab部分在内的全長抗體與Fc接受者結合的強度明顯更高(圖A)。
接下來,研究小組為詳細調查抗體與Fc接受者結合的位點,利用氫氘交換質譜,成功確定了Fab部分與Fc接受者結合的位點(圖B)。
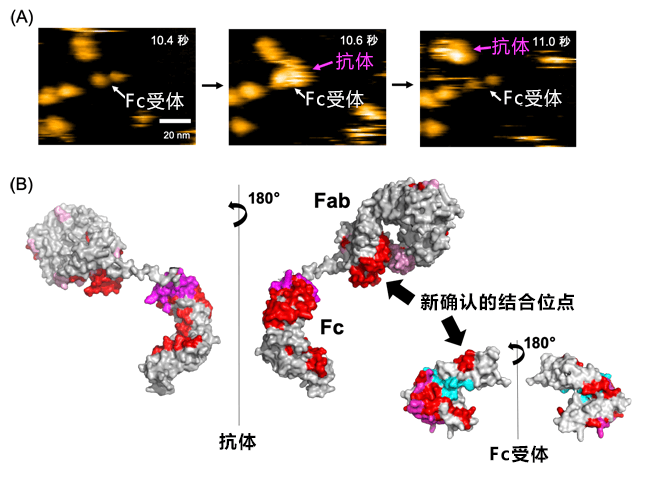
圖:(A)利用高速原子力顯微鏡觀察到的抗體與Fc接受者結合的情形。即時觀測到了抗體與Fc接受者獨特性結合併分離的情形。(B)利用氫氘交換質譜確認的抗體與Fc接受者結合的位點。紅色部分是抗體與Fc接受者結合的位點。
以前的研究很難利用包含Fab部分和Fc部分在内的全長抗體進行解析,因此這是首次成功捕捉到之前被忽視的Fab部分與Fc接受者的結合。此前認為僅與抗體的Fc部分結合的Fc接受者實際上還與Fab區域結合,這個發現顛覆了免疫學的常識。
研究意義及未來展望
此前一直認為與免疫細胞的Fc接受者結合的只有抗體的Fc部分,但此次的研究成果發現了Fab部分與Fc接受者結合的可能性,並成功確定了Fab部分與Fc接受者結合的新位點。
近年來,癌症等的治療廣泛使用了基於免疫功能的抗體藥物。通過改變本次研究確認的結合位置,有望開發出較原來增強了功能的抗體藥物。
文:JST客觀日本編輯部翻譯整理














