2019年9月6日,日本大鵬藥品工業株式會社(Taiho Pharmaceutical,總部:東京都千代田區;董事長:小林將之)連續發布新聞稿稱,該公司開發的抗惡性腫瘤藥物Lonsurf (日本商品名:ロンサーフ;通用名:三氟尿嘧啶鹽酸鹽,trifluridine/tipiracil,FTD/TPI;TAS-102)同時獲得中國和歐盟的身份鑑定(圖1)[1]。

圖1 日本市場上的Lonsurf
中國國家藥品監督管理局(National Medical Products Administration,NMPA)批准Lonsurf用於先前已接受過氟嘧啶、奧沙利鉑或伊立替康的化療或抗VEGF抗體療法、以及若RAS野生型則抗EGFR抗體療法、或無法接受現有常規療法的轉移性結直腸癌(mCRC)患者的治療。結直腸癌患者數近年在中國急劇攀升,目前是繼肺癌、胃癌、肝癌、食道癌之後的第五大癌症。2018年,中國約有25萬名患者死於結直腸癌。
本次批准主要依據此前由中國、韓國、泰國研究者主導實施的針對晚期或複發性結直腸癌患者的三期臨床(TERRA試驗)結果[文獻1]。國際多中心臨床研究結果顯示,Lonsurf與安慰劑對照組相比死亡風險顯著降低,中位總生存期顯著延長,研究達到了主要終點。疾病控制率(DCR)也顯著高於安慰劑組。包括毒性、有效性等整體結果與之前的國際性三期臨床研究結果相符。
大鵬製藥的合作方法國施維雅(Servier)製藥公司從歐盟委員會(European Commission,EC)獲悉,歐盟最終批准將胃癌列入Lonsurf新的適應症。Lonsurf用於既往已接受至少2種化療方案控制晚期或複發的轉移性胃癌(gastric cancer, GC)(包括轉移性胃食管交界腺癌[mGEJC])成人患者的單藥治療。對於晚期和複發的轉移性胃癌,美國在2019年2月26日、日本在2019年8月22日已經批准列為新的適應症(圖2)。
圖2 美國市場上的Lonsurf
Lonsurf在本次納入晚期轉移性胃癌適應症之前,在歐盟已經被批准用於既往已接受過當前可用療法(包括含氟嘧啶、含奧沙利鉑、含伊立替康的化療方案、抗VEGF製劑、抗EGFR製劑)或不適合這些療法的轉移性結直腸癌(mCRC)成人患者得治療。
7月,歐洲藥品管理局(EMA)人用醫藥產品委員會(Committee for Medicinal Products for Human Use:CHMP)已發布積極審查意見並遞交至歐盟委員會。本次歐盟委員會做出最終審查,主要基於針對標準療法難以奏效或不適應的晚期轉移性胃癌患者的三期臨床試驗(TAS-102 Gastric Study,TAGS試驗)中,本藥和安慰劑之間有效性和安全性的比較結果。相對於安慰劑的療效和安全性,Lonsurf總生存期(Overall Survival,OS)實現了臨床意義和統計學意義的改善,臨床研究達到了主要終點和次要終點[文獻2]。
胃癌作為世界第五大癌症,死亡率僅次於肺癌和大腸癌,位列第三。全球每年約有78萬人死於胃癌。歐洲每年約新增13萬胃癌患者,同時約有10萬胃癌患者離世。由於胃癌早期症狀不明顯,到確診時已約有40%患者轉化為晚期轉移性胃癌。對於晚期或複發轉移性胃癌患者,治療選擇方案有限,通常只能採取姑息治療。
由大鵬製藥研究開發的LONSURF 是一種新型口服核苷類抗腫瘤藥物,由FTD(三氟尿苷,trifluridine)和胸腺嘧啶核苷磷酸化酶抑制劑TPI(tipiracil)組成,不同於常規氟嘧啶的作用機制(圖3)。FTD是核苷類似物,可以干擾快速增殖癌細胞的DNA合成過程;TPI則是抑制FTD降解酶的活行,從而維持血液中FTD的濃度。
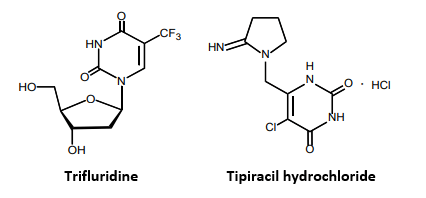
圖3 LONSURF 的主要活性藥物成分
2015年大鵬製藥和施維雅簽訂獨家合作協議,施維雅獲得Lonsurf在歐洲以及除北美與亞洲以外的全球其他國家和地區的共同開發和商業化賦權。臺灣地區從2018年起由臺灣東洋藥品工業株式會社代理者售賣;韓國則由第一藥品株式會社在積極準備推向市場中。
2014年3月,LONSURF 獲得日本批准用於晚期或複發轉移性結直腸癌(mCRC)治療;2015年獲得美國FDA批准;到2019年8月,全球已經在72個國家獲准用於轉移性結直腸癌。另外,2019年2月在美國、2019年8月在日本、2019年9月在歐盟被擴大到轉移性胃癌新適應症的治療。
供稿 宋傑 東京大學博士
文中圖片均取自大鵬製藥及子公司官網
編輯修改 JST客觀日本編輯部
參考文獻:
1. Xu, J., Kim T., Shen L., et al. Results of a Randomized, Double-Blind, Placebo-Controlled, Phase III Trial of Trifluridine/Tipiracil (TAS-102) Monotherapy in Asian Patients With Previously Treated Metastatic Colorectal Cancer: The TERRA Study, Journal of Clinical Oncology, 2018; 36(4): 350-358.
2. Shitara K, Doi T, Dvorkin M, et al. Trifluridine/tipiracil versus placebo in patients with heavily pretreated metastatic gastric cancer (TAGS): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Oncol 2018; 19: 1437–48World Health Organisation.
相關鏈結:
1. AnGes官網相關報導













