日本國立研究開發法人量子科學技術研究開發機構(以下簡稱「量研」)量子醫學醫療部門放射線醫學綜合研究所先進核醫學基礎研究部的主任研究員謝琳、研究員破入正行及部長張明榮等人,成功開發出了與癌細胞表面存在的代謝型麩胺酸1型接受者(mGluR1)結合,針對惡性黑色素瘤釋放α射線的新型靶向同位素治療候選藥物211At-AITM,並通過模型小鼠確認了抑制癌細胞繁殖的效果。
惡性黑色素瘤是一種罕見癌症,在日本每10萬人中約有1~2人罹患此病,不僅是皮膚,還會出現在眼球、鼻腔、口腔及食道等粘膜上。如果惡性黑色素瘤僅發生在皮膚和粘膜上,可以通過外科手術切除病灶部位及其周圍組織進行治療。
但如果生長在臉部和頭頸部,則會嚴重損害這些部位的功能和姿容,多數情況都難以通過外科手術治療,而是結合放療和抗癌藥等進行治療。另外,如果已經轉移到淋巴結和其他器官,則需要結合外科手術、放療和抗癌藥等藥物療法進行治療,但以往的放射療法難以生效,預後較差,需要開發新的治療方法。近年來,通過免疫檢查點抑制劑和分子靶向藥物提高療效的方法受到期待,但研究發現,這兩種方法均有副作用,而且醫療效果也因人而異。
量研的目標是結合從體體外曝露放射線治療癌症的重粒子線治療法,以及利用投入體內的放射核種釋放的放射線治療癌症的靶向同位素治療法,同時治療原發癌(最初發生的癌症)和轉移癌,為此一直在推進相關研究開發。在針對頭頸部的粘膜惡性黑色素瘤的重粒子線治療中,難以利用外科手術治療的病例也取得了良好的治療效果,目前已被納入醫療保險。
另一方面,在靶向同位素治療中,量研利用加速器成功製造了放射核種211At,放射線的輻射距離為幾個細胞那麼遠,會釋放對命中細胞的殺傷力較高的α射線。如果能將211At有效地送到癌細胞中,則有望做到在不損害周圍正常組織的情況下,治療癌症。
因此,作為使211At抵達惡性黑色素瘤的方法,量研著眼於與正常細胞相比,高密度存在於癌細胞表面的蛋白質——代謝型麩胺酸1型接受者(mGluR1)。已知mGluR1存在於惡性黑色素瘤和乳房癌等多種癌細胞的表面,與癌症的形成和生長密切相關。
為此,先進核醫學基礎研究部從數年前就認為,mGluR1有望成為開發癌症診斷和治療藥物的靶分子,一直在大力開發與mGluR1結合的放射性藥品。目前已開發出通過正電子發射斷層顯像(PET:Positron Emission Tomography)用放射性同位素18F和11C,標記與mGluR1蠻力結合的多種低分子化合物的診斷用放射性藥品。利用這些藥物,成功對活體動物的癌細胞實施了PET成像。
本研究利用此前開發與mGluR1結合的化合物,以及開發利用放射性同位素標記該化合物的藥物時積累的技術和臨床試驗經驗,新開發了與mGluR1結合釋放α射線的新型靶向同位素治療候選藥物211At-AITM(4-211At-astato-N-(4-(6-(isopropylamino)pyridine-4-yl)-1,3-thiazol-2-yl)-N-methylbenzamide)(圖1),並利用模型小鼠,評價了針對惡性黑色素瘤的抑癌效果。
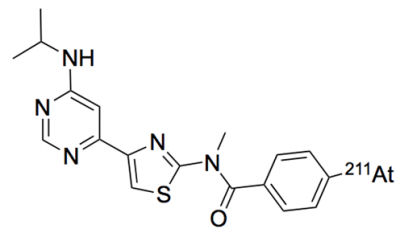
圖1:211At-AITM的結構式
研究小組在與高密度存在於惡性黑色素瘤癌細胞表面的mGluR1蠻力結合的低分子化合物ITM (N-(4-(6-(isopropylamino)pyrimidin-4-yl)-1,3-thiazol-2-yl)-N-methylbenzamide)中添加211At,製作了211At-AITM。
然後向皮下移植了惡性黑色素瘤細胞的模型小鼠靜脈注射一次211At-AITM,調查了癌症尺寸的變化。最終確認,分別注射1.11MBq6、1.85MBq和2.96MBq的211At-AITM的群組,與沒有注射211At-AITM的群組相比,均顯著抑制了癌細胞的繁殖(圖2)。
在注射2.96MBq的211At-AITM的群組,還出現了癌症完全消失的小鼠。
另一方面,注射211At-AITM的所有群組均未觀察到擔心的體重減輕等副作用。
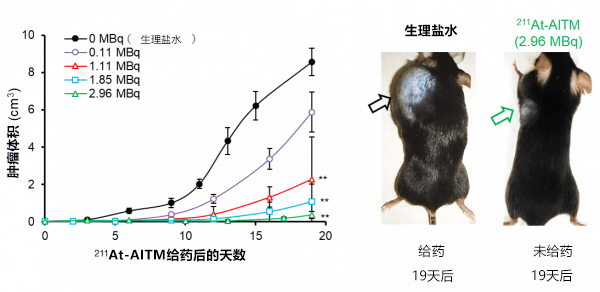
圖2:通過注射211At-AITM抑制癌細胞繁殖的效果比較
文:JST客觀日本編輯部翻譯整理














