生物藥品等領域需求不斷高漲的特殊蛋白質存在著生產成本較高的課題。為改變這種情況,日本產業技術綜合研究所生物醫學研究部門的研究組長大石勳博士著眼於生產成本比較低的雞蛋,通過基因編輯技術重組雞的基因,讓雞產下含有大量特殊蛋白質的「金蛋」,實現了低成本製造特殊蛋白質。

讓物價「優等生」生產蛋白質
近年來,以生物藥品為中心,蛋白質市場迅速擴大。隨著再生醫療的研究越來越活躍,誘導未分化細胞分化的蛋白質的需求也不斷高漲,預計今後蛋白質的市場將進一步擴大。
不過,蛋白質的製造技術還存在課題。目前主要採用的方法是把想製造的蛋白質的基因導入培養細胞進行生產,但建設和運營製造工廠等需要巨額資金,而且製造重組蛋白質涉及各種專利,甚至被稱為「專利叢林」,需要支付大量的專利使用費。
所以,這類特殊蛋白質的製造成本最低也高達每克數千日元,還有不少超過10萬日元的,製造成本阻礙了市場的擴大。為此業界嘗試通過操作動植物的基因而非培養細胞來生成有用蛋白質,一些技術已經實用化,比如山羊奶和草莓果實等。
日本產業技術綜合研究所生物醫學部門尖端基因體設計研究小組的組長大石勳,正在進行讓雞蛋含有特殊蛋白質的研究。關於使用雞蛋的理由,大石解釋如下。
「雞蛋的生產原理非常明確,生產成本非常低,被稱為‘物價優等生’。一個雞蛋的蛋清中約含4克蛋白質,因此即使只能置換其中一部分,也能低於現行的成本來生產蛋白質」。
另外,主要由水和蛋白質構成的蛋清還具有雜質少、易於純化的優點。基於這些特點,國内外的很多研究人員都在開發利用雞蛋生產特殊有用蛋白質的技術,但迄今為止尚無實用化的先例。大石說:「原因在於難以改變雞的基因」。
利用基因編輯技術在目標位置導入基因
要想改變動物的基因,需要操作受精後、細胞分裂前的受精卵基因。因為如果能在單細胞階段導入基因,重組的基因就可以通過之後的細胞分裂遍佈到所有細胞中。但雞的受精發生在輸卵管深處,而且卵細胞上附有巨大的蛋黃,因此幾乎不可能導入基因(圖1)。
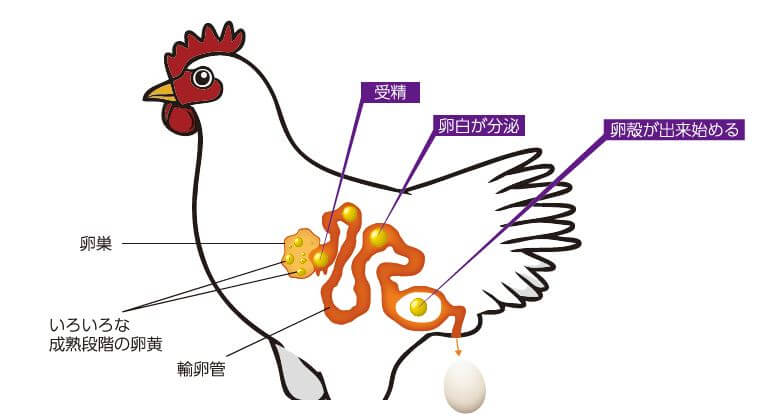
■圖1:雞的受精發生在體內深處,在輸卵管内移動24~27小時,期間形成雞蛋。受精後很難立即取出受精卵,如果是產卵後則細胞增加太多,所以與其他動物相比,基因操作更加困難。
既然無法在受精後立即操作,那麼能否向產出的雞蛋中導入基因呢?於是研究人員又做了另一個實驗,即讓雞蛋感染含有目標基因的病毒載體。但難度較大,大石說:「這十幾年來,很多研究人員都在挑戰這個課題,但存在導入效率低等問題,始終未能從蛋清中獲得足夠的蛋白質」。
對此,大石嘗試的方法是利用從早期雞胚中提取的原始生殖細胞。原始生殖細胞是成熟後會變成精子和卵子的細胞,如果改變原始生殖細胞的基因並將其移植到其他雞蛋中,就可以將目標基因導入雞的體內。
大石回憶說:「這是一家美國的生物初創企業2006年開發的方法。我看了一份報告,裏面介紹說通過導入綠色螢光蛋白(GFP)的基因,培育了發綠色光的雞,我覺得或許可以使用這種方法」。
大石反復進行了實驗,但進展並不順利。促使研究出現轉機的,是作為新的基因操作技術開始普及的CRISPR-Cas9基因編輯技術。相對於病毒載體法在染色體哪個位置導入基因完全取決於病毒而言,CRISPR-Cas9則通過將RNA作為向導,能切斷目標位置並在該位置導入基因。
為了儘可能多地生產蛋白質,大石確定的導入位置是約佔蛋清中蛋白質總量50%的卵白蛋白基因的位置(基因座,圖2)。導入的基因選擇了干擾素β(IFN-β)。大石介紹說:「(IFN-β)是一種能誘導對病毒產生抗體的生理活性物質,除了用來治療多發性硬化症、惡性黑色素瘤和肝炎等之外,也作為研究用試劑。目前10微克IFN-β的售價高達2~5萬日元,所以極具商業挑戰的價值」。

敲開蛋殼上部,在顯微鏡下注入已導入基因的細胞。把針尖上的細胞注入胚胎,這是一項要求非常精準的工作。
蛋清中含大量IFN-β,通過交配繁殖雌雞
大石開發的方法是首先從雄雞的早期胚胎中提取原始生殖細胞,並利用CRISPR-Cas9技術在卵白蛋白的基因座處導入IFN-β基因(圖3);然後將該原始生殖細胞移植到其他雞蛋(接受者胚)中後,孵出來的雄雞就會同時擁有源自轉基因的原始生殖細胞的精子和源自接受者胚的精子(性腺嵌合體雞 第0代)。使該雄雞與未進行基因操作的自然雌雞交配,孵化出來的就是第一代轉基因雞。第1代轉基因雌雞產的雞蛋中含有大量IFN-β。
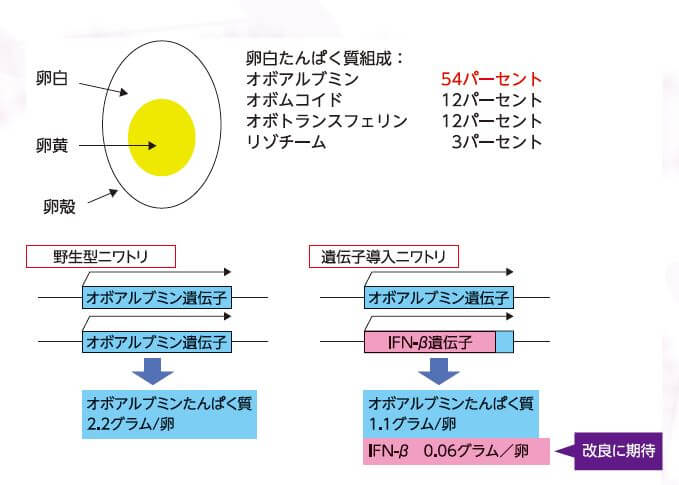
■圖2:在蛋清中含量最高的卵白蛋白的基因座中導入IFN-β基因。通過進行基因編輯,可以向卵白蛋白的基因座導入。
大石強調說:「卵白蛋白被認為與蛋殼的形成有關,因此最初一直擔心第1代雌雞能否產蛋。不過最終順利產蛋,而且每顆雞蛋含30~60毫克的IFN-β」(圖4)。根據IFN-β的售價單純計算的話,一顆雞蛋的價格高達6000萬日元至3億日元,真可謂是下「金蛋」的雞。
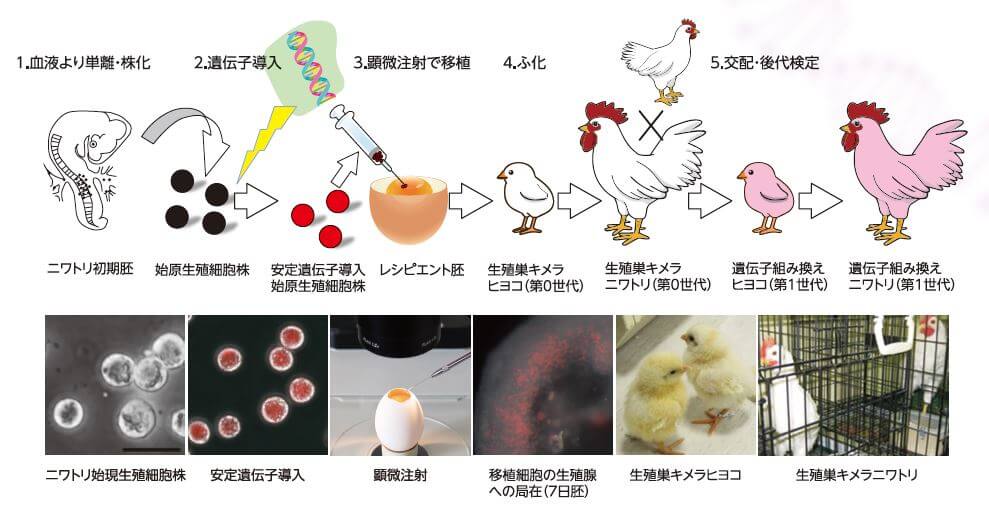
■圖3:利用基因編輯技術向雞體內導入基因。首先提取原始生殖細胞,通過基因操作嵌入目標基因,在顯微鏡下移植到其他雞蛋(接受者胚)中。使孵出來的雄雞與未進行基因操作的雌雞交配,產蛋孵化轉基因雞。
不過,還需要對蛋清進行純化和實施活性化處理,雞蛋本身並不能直接賣高價,但利用蛋清生產大量特殊蛋白質的意義非常重大。第1代雌雞至少能連續產蛋5個月,因此應該可以作為生產有用蛋白質的生物工廠充分進行利用。
大石說:「另外值得一提的是,蛋白質的生產能力還可以通過繁殖傳遞給下一代」。由於含IFN-β的雞蛋不能孵化,雌雞無法留下後代,但讓攜帶IFN-β基因的雄雞與野生型雌雞交配就能孵出攜帶該基因的雞蛋,然後再孵化出雞(圖5)。這樣得到的第3代以後的雞也保留著導入的基因,這表明通過繁殖可以增加下「金蛋」的雞。大石充滿期待地表示:「家禽養殖領域逐漸確立了通過冷凍保存精子將其用於人工授精的技術。如果轉基因雞也能保持精子的話,應該會便於這種方法的推廣」。

■圖4:含IFN-β的蛋清(左)與普通雞蛋(右)相比顏色濁白。一顆雞蛋含30~60毫克IFN-β。
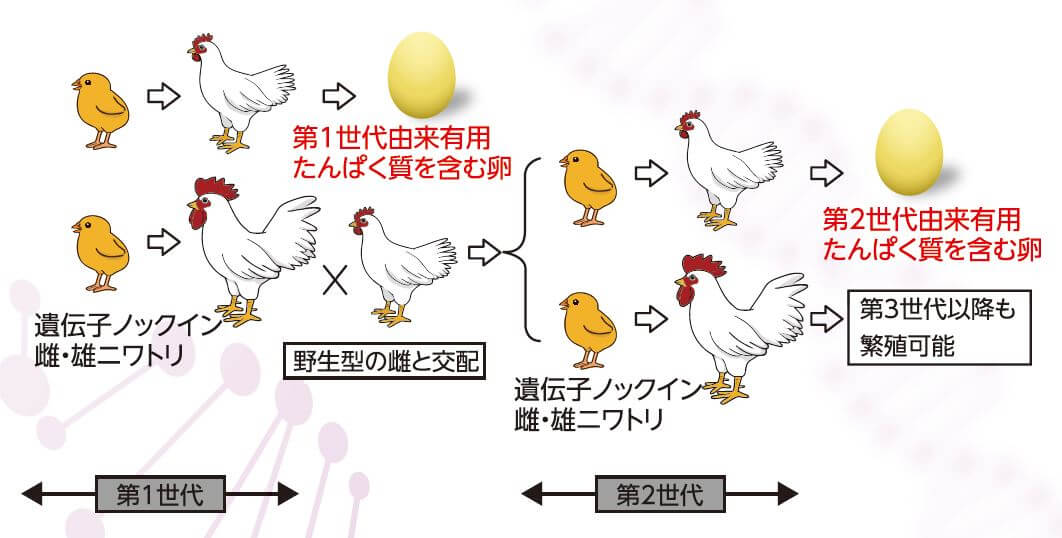
■圖5:導入的IFN-β基因可以通過繁殖傳遞給下一代,因此無需複雜的操作就能繁殖「下金蛋的雞」。
利用日本企業專利,通過受託生產磨鍊技術
利用原始生殖細胞的基因導入法理論上還可應用於IFN-β以外的其他有用蛋白。獲得大石的技術賦權和經驗的Cosmo Bio公司(東京都江東區)已從2019年7月開始受託生產。今後計劃推進把企業希望生產的蛋白質基因導入雞體內,製造和純化蛋白質的研究開發,目標是通過增加可以應用基因導入法的蛋白質的種類,改良純化技術。
大石充滿信心地表示:「IFN-β雖然取得了成功,但並非所有蛋白質都能一樣順利成功。受基因長度等的影響,也可能無法在蛋清中表達,因此計劃積累案例,最適化針對各基因的技術非常重要。研究進展順利的話,有望低成本量產各種蛋白質」。
另一方面,推進商業化進程時擔心的是用於改變基因的CRISPR-Cas9專利問題。CRISPR-Cas9的專利由海外研究機構持有,用於商業用途的話,需要向持有專利的2家機構支付使用費。因此,大石等人著眼於大阪大學的初創企業C4U(大阪府吹田市)持有專利的CRISPR-Cas3技術。這項基因編輯技術是日本的國產技術,與CRISPR-Cas9專利不衝突,即使支付使用費,也能為振興國内產業做貢獻。
利用雞蛋生產有用蛋白質的技術正通過與國内企業合作的產官學研合作體制穩步推進實用化。利用國產技術低成本量產有用蛋白質的成功,勢必會為產業界帶來巨大的衝擊。

研究室裏的帶自動轉蛋功能的孵蛋機
原文:JSTnews 2019年9月號
翻譯·編輯:JST客觀日本編輯部














