日本自然科學研究機構生命創成探究中心(ExCELLS)及分子科學研究所的村木則文助教、青野重利教授、伊藤曉助教、奧村久士副教授及石井健太郎研究員,與大阪大學研究生院工學研究科内山進教授等人組成的研究團隊,查清了表達活性的金屬酶(図1氫化酶)所必需的一氧化碳是如何在體內合成的。
相關研究論文已於2019年10月18日發表在Nature Research發行的國際學術期刊《通訊-生物學》(Communications Biology)的網路版上。
研究背景
氫化酶作為催化氫氣的氧化反應和質子的還原反應的金屬酶,在細菌等的氫代謝中發揮著核心作用。另外,最近用作燃料電池觸媒的開發也備受期待。根據酶中所含的金屬離子的不同,氫化酶可分為「鎳-鐵型」、「鐵-鐵型」和「鐵型」三種不同類型。酶的活性中心即是蛋白質中結合的結構各異的金屬錯合物(圖1)。雖然這三種酶的活性中心結構不同,但無論是哪種類型,一氧化碳(CO)與活性中心的鐵離子配位是氫化酶具備活性的必要條件。儘管以前的研究已經知道這裏的一氧化碳是體內合成的,但尚並不清楚具體合成路徑。
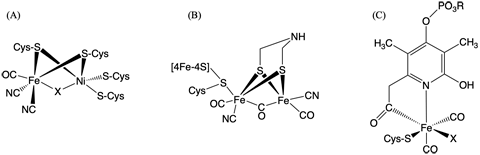
圖1:(A)鎳-鐵型、(B)鐵-鐵型、(C)鐵型氫化酶的酶活性中心結構
研究成果
本次研究解析了與鎳-鐵型氫化酶利用的一氧化碳生物合成有關的酶(HypX)的晶體結構,發現HypX通過從未報導過的反應途徑合成了一氧化碳。HypX由N末端結構域和C末端結構域兩個結構域構成,分子内部存在橫跨這兩個結構域的巨大空腔(圖2)。另外還確定,輔酶A(coenzyme A: CoA)與C末端結構域側的空腔結合。
HypX的N末端結構域和C末端結構域分別發生兩種不同的化學反應。在N末端結構域,作為反應基質與N末端結構域中的空腔結合的甲酰四氫葉酸向CoA發生甲醯基轉移反應(圖3中的反應步驟1)。此時,空腔中的CoA呈直鏈狀延伸的構形。CoA末端的-SH基位於與N末端結構域結合的甲酰四氫葉酸中的甲醯基一側,通過向CoA發生甲醯基轉移反應,生成甲酰-CoA反應中間體。生成的甲酰-CoA的構形會在空腔中發生巨大變化,從而使CoA分子末端的甲醯基挪位於HypX的C末端結構域中的酶活性位(圖3中的反應步驟2)。甲酰-CoA在C末端結構域會發生一氧化碳脫離反應,生成一氧化碳和CoA(圖3中的反應步驟3)。
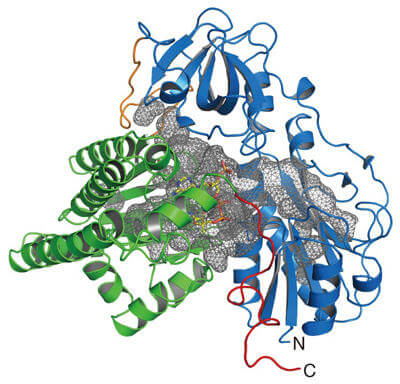
圖2:HypX的晶體結構。N末端結構域用藍色表示、C末端結構域用綠色表示。HypX分子中存在的空腔用灰色網格表示。
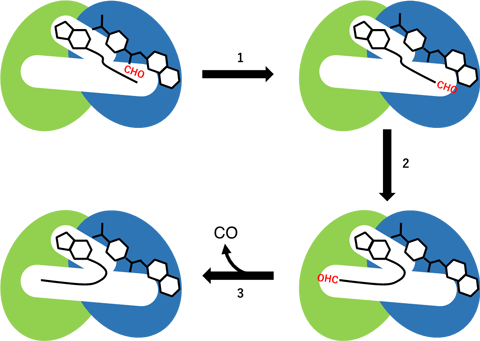
圖3:基於HypX的一氧化碳合成反應的反應步驟(示意圖)。N末端結構域用藍色表示、C末端結構域用綠色表示、甲醯基用紅色表示。
論文資訊
發表期刊:《通訊-生物學》
論文題目: 「Structural characterization of HypX responsible for CO biosynthesis in the maturation of NiFe-hydrogenase」
DOI:10.1038/s42003-019-0631-z
文:JST客觀日本編輯部翻譯整理














