日本產業技術綜合研究所(以下簡稱「產綜研」)與植草學園和順天堂大學合作,培育出了僅在神經細胞内表達阿茲海默症(AD)致病因子之一β-澱粉樣蛋白(Aβ)的寡聚體、並表現出發病初期症狀的新AD模式小鼠。
此前的研究認為,阿爾茲海默病是由於Aβ聚集形成老年斑,並在大腦神經細胞周圍積聚而引起的。不過,最近越來越多研究顯示,神經功能障礙在老年斑形成之前就已經出現。引起神經功能障礙的,是少量Aβ分子聚合形成的Aβ寡聚體。
產綜研此前發現,Aβ與綠色螢光蛋白GFP(Green Fluorescent Protein)融合表達時會在細胞内形成三聚物前後的寡聚體。研究團隊此次即培育了表達該融合蛋白,並在神經細胞内獨特性積聚的AD模式小鼠。該小鼠顯示出AD發病初期因寡聚體毒性而引起的神經功能障礙症狀。該小鼠模型有望為AD發病原因探索、AD預防以及在發病初期抑制病情惡化的新藥開發做出貢獻。相關研究已於2019年11月22日發表在《科學報告》(Scientific Reports)期刊的網路版上。
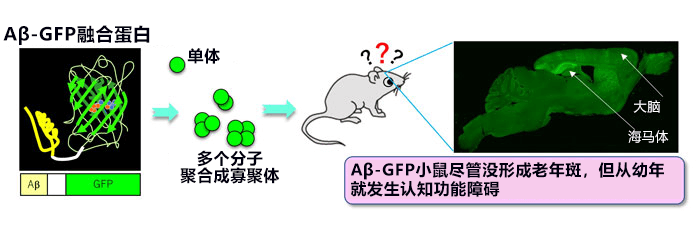
圖1 概要圖
培育出表達Aβ-GFP融合蛋白質(示意圖左)的寡聚體的AD模式小鼠(Aβ-GFP小鼠)。Aβ寡聚體在大腦海馬體和大腦皮層的神經細胞内過表達(右圖)。
此次培育的AD模式小鼠是表達Aβ-GFP融合蛋白的轉基因小鼠(Aβ-GFP小鼠)。Aβ-GFP小鼠並非表達澱粉樣前驅物蛋白( amyloid precursor protein,APP) ,而是僅表達高毒性Aβ 1-42與GFP的融合蛋白,因此無需考慮因APP過表達而產生Aβ以外生理活性肽的作用。由於沒有胞外分泌訊息序列,因此僅在細胞內積累Aβ寡聚體,只會在大腦內海馬體和大腦皮層等神經細胞中過表達。如圖2A所示,與僅表達GFP的對照小鼠(右)相比,在Aβ-GFP小鼠(左)的神經細胞中發現大量Aβ-GFP小顆粒,表明Aβ在細胞内形成了寡聚體。
AD的主要病理特徵為:以Aβ為主要成分的老年斑在神經細胞周圍沉積物,過度磷酸化的Tau蛋白在神經細胞內積聚形成神經原纖維纏結、腦萎縮。Aβ-GFP小鼠僅形成Aβ寡聚體,沒有胞外分泌,因此不會形成老年斑,也不發生腦萎縮;但隨著年齡的增加,Tau蛋白的磷酸化會加劇。
研究團隊在對記憶和學習至關重要的大腦「海馬體」 區域,評估了突觸的可塑性。發現模式小鼠與正常小鼠相比,突觸傳導在刺激下的長效增益作用(LTP)顯著降低(圖2B)。研究人員認為這與細胞水平的記憶形成有關,表明記憶形成功能出現異常。另外,樹突棘的數量和部分突觸蛋白的量也變少。這些現象與此前利用從死亡AD患者大腦中提取的Aβ寡聚體和合成的寡聚體進行的研究結果一致,表明Aβ-GFP具有與人類的Aβ寡聚體相同的高毒性。
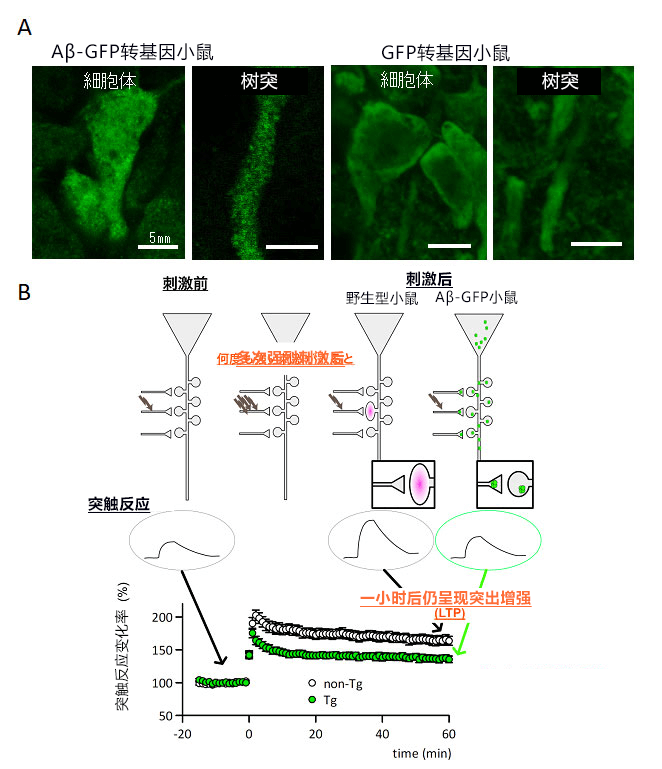
圖2:小鼠神經細胞内表達的Aβ寡聚體(A)和通過LTP解析在細胞水平進行的記憶和學習能力驗證(B)。Tg表示此次開發的模式小鼠,non-Tg表示野生型。
文:JST客觀日本編輯部翻譯整理














