日本慶應義塾大學醫學部的佐藤俊朗教授等人組成的研究團隊發現,潰瘍性大腸炎的大腸組織中存在特定的基因突變累積。
隨著年齡的增長,正常大腸上皮會發生越來越多的基因突變,成為大腸癌變的原因之一。另外,飲食質量和慢性發炎等腸道環境的各種變化也會導致大腸的癌變風險升高。不過,此前一直不清楚腸道環境的變化是否對大腸上皮基因突變累積有影響。
本次研究對患者的大腸上皮進行體外培養後解析了大腸上皮細胞的基因突變。與健康個體相比,長期潰瘍性大腸炎患者的大腸上皮細胞中檢測出了更多的基因突變。並且這些基因突變大多都不是大腸癌關聯基因突變,而是與慢性發炎相關聯的基因突變。
研究團隊進而採用體外培養器官的類器官技術,查清了上述基因突變的作用。
在潰瘍性大腸炎中,IL-17(白血球介素17)的慢性發炎信號被激活。雖然活化刺激會傷害大腸上皮,但研究發現,潰瘍性大腸炎的大腸上皮出現了健康個體沒有的IL-17關聯基因突變,以使細胞免受發炎傷害。也就是說,在潰瘍性大腸炎患者的大腸中,適應發炎環境生存的基因突變上皮細胞會選擇性增加,逐漸取代正常的大腸上皮細胞。
已經有報告顯示,人類的大腸發生基因突變累積後會導致大腸癌(Fearon ER, et al. Cell 1990.)。本次研究發現,大腸還會積聚適應慢性發炎等腸道環境變化的基因突變。
大腸上皮細胞基因突變的累積會對潰瘍性大腸炎的病狀和癌變產生什麼影響?今後的研究備受期待。
本次相關研究成果已於2019年12月18日線上發表在英國科學期刊《Nature》上。
1.研究背景
潰瘍性大腸炎是大腸發生原因不明慢性發炎的發炎性腸病之一。日本目前約有17萬多患者,而且人數一直在持續增加。據報告,患潰瘍性大腸炎的時間越長,大腸癌的發生機率就越高。但至於為何風險會增加,此前一直不清楚明確的原因。
很多癌症都是隨著年齡增長而累積的基因突變誘發的。因此,研究人員認為發炎也可能會影響基因突變的累積。想證明這個假說,就需要對潰瘍性大腸炎大腸組織的基因進行解析。但由於技術受限,之前很難實現。
已知在大腸隱窩凹陷中會存在10-20個幹細胞,隻需幾個月時間單個幹細胞由來的後代細胞就會將整個隱窩的細胞全部置換掉(單個幹細胞產生的所有細胞都稱為「選殖」)。
大腸在狹窄的空間内就存在無數隱窩。因此以往的方法,只能使用有突變和未突變的幹細胞選殖混合樣本,無法調查單個幹細胞是如何積累基因突變的(圖 1)。
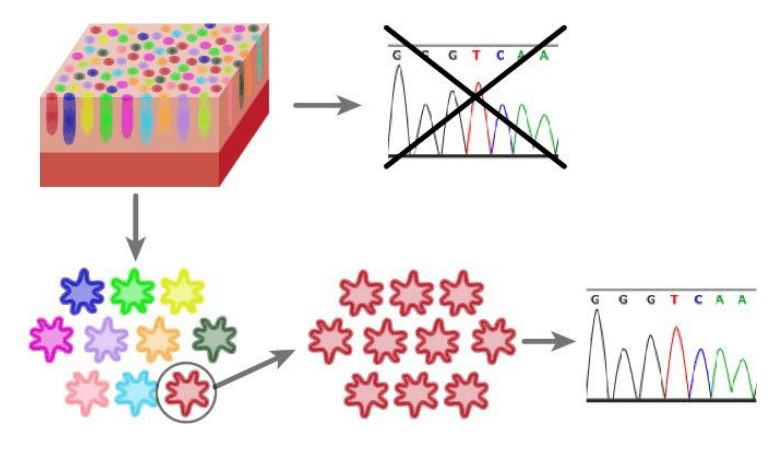
【圖1】應用選殖技術對單個幹細胞的基因突變進行解析:通過基於類器官培養的選殖技術,可以對單個幹細胞選殖實現增殖,然後進行基因體解析。
近年來,研究人員開發出了通過類器官培養技術,體外增殖各隱窩單個幹細胞選殖並逐一解析的方法(圖1)。據報告顯示,正常大腸上皮幹細胞的基因突變積累與年齡成正比(Blokzijl F, et al. Nature2016),同時也顯示基因突變累積存在個別差異。
本次研究團隊認為,這種個別差異可能與腸道環境有關。因此著眼於右側大腸(大腸靠近嘴的一端)未發生發炎,僅左側大腸(大腸靠近肛門的一端)出現發炎的左側結腸炎型潰瘍性大腸炎,對其單個幹細胞選殖進行了詳細的基因解析,成功查清了腸道環境之一的慢性發炎對幹細胞基因突變積累產生的影響。
另外,還利用類器官查清了潰瘍性大腸炎的發炎環境中發生了怎樣的基因突變,以及這些基因突變在發炎中發揮了哪些作用。
2.研究成果、意義以及未來展望
本研究利用類器官培養技術,對健康個體和潰瘍性大腸炎患者的大腸組織進行體外培養,明確了其幹細胞是如何發生基因突變的。
觀察發現,潰瘍性大腸炎患者因發炎影響,大腸上皮的基因突變頻率較健康個體增加。不過,其中引起發炎的關聯基因突變頻率增加很小。
因此,研究團隊著重調查哪些基因發生了突變累積的質變而非量變問題,發現潰瘍性大腸炎患者幹細胞中癌變關聯基因突變相對較少,而引起發炎的IL-17(白血球介素17)細胞介素介導的發炎信號通路上發生了各種基因突變。(圖 2)
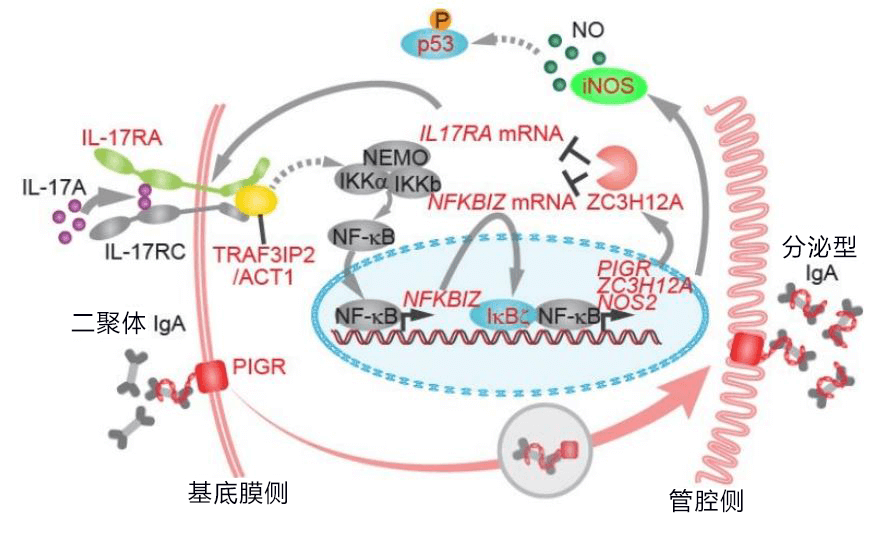
【圖2】潰瘍性大腸炎患者的大腸上皮幹細胞中積累的抗炎性基因突變:此次發現的IL-17信號上的基因突變(紅字)。IL-17A與接受者結合後,其下游的ACT1和NFKBIZ被激活,最終經由iNOS激活p53,引起細胞死亡。
為調查該基因突變選殖的擴散,團隊研究了更多患者的樣本,探索在用活檢鉗採集的部分中所有大腸幹細胞中這些基因突變發生的程度。
在接受調查的45名潰瘍性大腸炎患者中,有60%(27人)確認發生上述基因突變;另外,並發大腸癌的患者中75%以上的在沒有癌變的大腸上皮細胞發生了基因突變。此外還確認,發生這些基因突變的幹細胞選殖增加。
活動性潰瘍性大腸炎患者的大腸上皮細胞會在發炎的影響下發生慢性細胞傷害,已知IL-17在這些引發發炎的物質中扮演重要角色。研究團隊比較了發生基因突變的細胞與正常細胞中受IL-17刺激時的細胞毒性。比較確認,正常的大腸上皮細胞會發生程序性程式性細胞死亡;但發生基因突變的則對程式性細胞死亡表現出抗性,即使有IL-17存在(在IL-17引起的發炎下)也可以存活。
這表明,在發炎情況下,正常細胞會傷害並脫落。而存在此次鑑定的基因突變的細胞則可以不受傷害繼續存活,進而逐步擴大突變的選殖範圍(圖3)。由此成功驗證了發炎使發生特定基因突變的大腸上皮細胞選殖增加的機制。
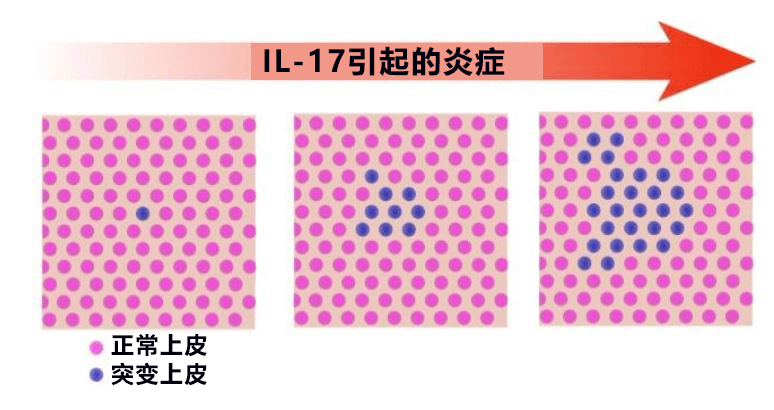
【圖3】在發炎下突變選殖增加的機制:在IL-17引起的發炎下,所鑑定基因突變的幹細胞選殖(藍色)區域對發炎傷害產生抗性,在長期的發炎過程中其浸潤範圍不斷擴大。
此次研究發現,很多潰瘍性大腸炎患者的大腸上皮為適應發炎環境,會積聚對發炎有抗性的基因突變(抗炎性基因突變),而且其選殖浸潤範圍會逐漸擴大。這些基因突變在並發大腸癌的潰瘍性大腸炎患者體內更為常見,因此有望作為潰瘍性大腸炎患者中大腸癌高風險群體的生物標誌物。
另一方面,癌變部位中並未發現這些抗炎性基因突變。因此癌變應該是從未產生突變的上皮發生的,抗炎性基因突變可能會抑制發炎細胞癌變(圖 4)。
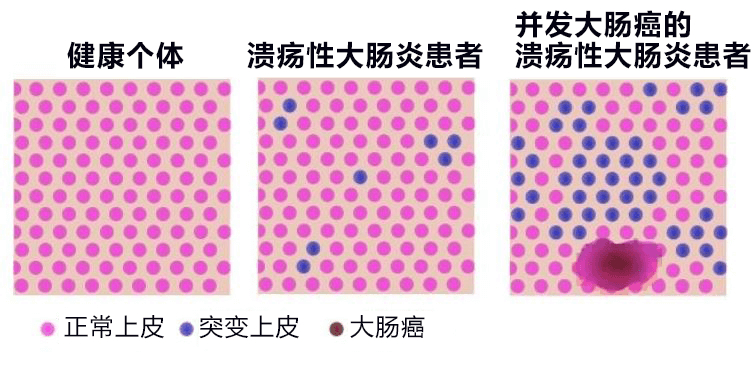
【圖4】抗炎性基因突變與並發大腸癌的關係:患大腸癌的潰瘍性大腸炎患者,基因突變的幹細胞選殖割據面積擴大。同時大腸癌隻在未突變的上皮部位發生。
有趣的是,以往小鼠實驗顯示,此次發現的基因突變擴散到大腸粘膜後,腸道環境會發生變化,導致腸炎惡化。這表明,在人類的潰瘍性大腸炎中抗炎性基因突變除了壓制性突變細胞癌變的同時,可能會導致腸炎惡化從而引起其周圍未突變的細胞癌變。
這項研究成果有望為查清此前不清楚原因的潰瘍性大腸炎存在慢性治療困難和病情加重等現象提供重要線索。
論文資訊
題目:Somatic inflammatory gene mutations in human ulcerative colitis epithelium
期刊:《Nature》
文:JST客觀日本編輯部翻譯














