日本北海道大學遺傳病調控研究所的北村秀光副教授與該校研究生院醫學研究院的武富紹信教授等人組成的研究團隊,成功查清了促進大腸癌轉移的新控制機制,有望用來最適化癌症免疫治療。
在癌症惡化和複發的患者體內,負責消除癌細胞的抗腫瘤免疫細胞會功能失調。對於癌症治療,控制複發和轉移非常重要。但此前一直不太清楚體內免疫系統的癌症轉移控制機制。
本研究通過建立大腸癌肝轉移小鼠模型,對大腸癌細胞肝轉移竈的形成與寄主免疫系統之間的關係進行了研究。研究發現,荷瘤小鼠體內產生的發炎性細胞介素之一IL-6會抑制抗腫瘤免疫,並促進大腸癌細胞轉移竈的形成。研究還確認,在癌症環境下當IL-6缺損時,以PD-L1免疫抑制性分子為靶點的免疫檢查點抑制療法的抗腫瘤效果增強,肝轉移模型小鼠的生存率顯著提高。
今後有望利用這項研究成果,最適化免疫檢查點抑制療法等癌症免疫治療手段。
研究團隊此前確認,荷瘤小鼠體內產生的IL-6會抑制樹突狀細胞的成熟和活化,會對導入抗腫瘤效應T細胞來消除癌細胞產生抑制作用(圖1)。本研究明確了IL-6在抗腫瘤免疫與大腸癌複發和轉移之間的關係,同時還嘗試將其應用於新的癌症免疫療法開發。
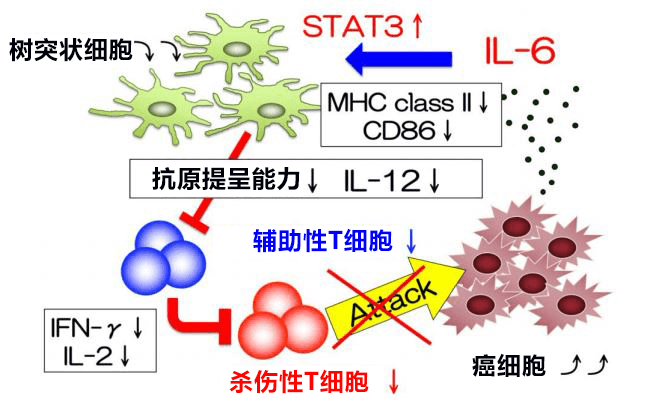
圖1:荷瘤小鼠體內產生的IL-6作用於樹突狀細胞,抑制其抗原提呈能力和細胞介素的產生。由此導致輔助性和殺傷性T細胞等抗腫瘤效應細胞不能順利工作,癌細胞無法從體內消除。
團隊發現,與野生型大腸癌肝轉移模型小鼠相比,IL-6缺陷小鼠的肝轉移竈形成明顯減弱;去除CD8陽性殺傷性T細胞後,抑制轉移竈形成的效果會減弱。另外,IL-6缺陷時產生細胞毒性分子穿孔素和顆粒酶B的抗腫瘤效應T細胞及MHC II類會高表達;表達IFN-α/β和IL-12的成熟型樹突狀細胞以更高的頻率向肝轉移竈聚集;但同時通過抑制IFN-α/β接受者及中和IL-12,會加劇本模型的肝轉移竈形成。此外發現,向肝轉移小鼠施用抗PD-L1抗體的免疫檢查點抑制治療後,與野生型相比,IL-6缺陷小鼠的生存率顯著提高。
以上研究結果表明,荷瘤小鼠產生的IL-6會抑制樹突狀細胞的成熟和活化,導致抗腫瘤效應T細胞無法消除大腸癌細胞,從而促進大腸癌細胞肝轉移竈的形成(圖2)。今後有望通過抑制荷瘤小鼠產生的IL-6,來降低大腸癌的複發和轉移。另外,通過控制IL-6還有望最適化以免疫抑制分子PD-L1為靶點的免疫檢查點抑制療法(圖 3)。
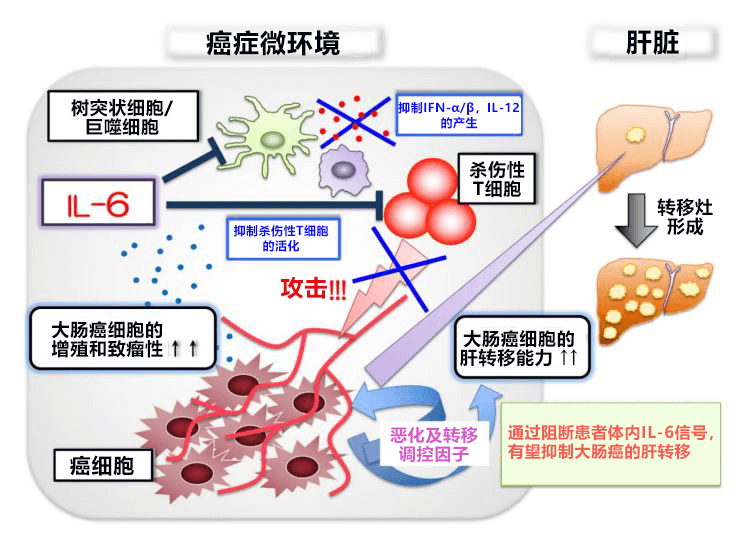
圖2:在大腸癌肝轉移模型中,IL-6通過抑制樹突狀細胞和巨噬細胞的細胞介素產生以及殺傷性T細胞的活化,來促進大腸癌細胞的增殖和肝轉移竈的形成。因此,通過阻斷IL-6信號,有望抑制大腸癌向肝臟的轉移。
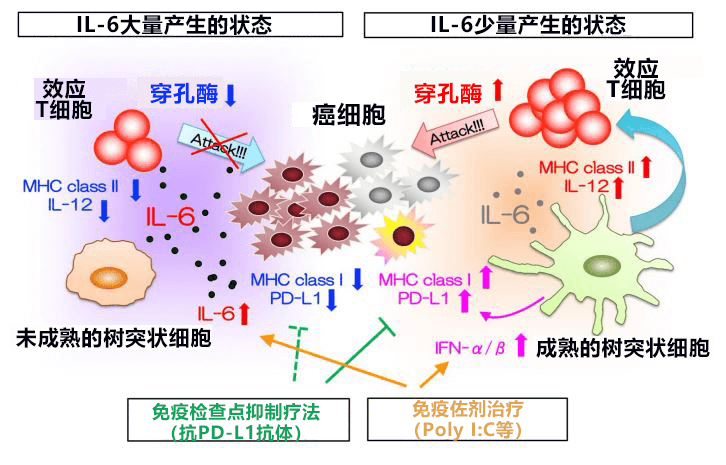
圖3:在大量產生IL-6的狀態下,免疫細胞被抑制,無法順利攻擊癌細胞。而在IL-6產生量較少的狀態下,樹突狀細胞被激活,有望通過抗腫瘤效應T細胞攻擊癌細胞。不過,在這種狀態下會大量產生IFN-α/β,因此PD-L1分子表達增強,會加重癌細胞的免疫逃逸。因此,對IL-6較少的患者實施免疫檢查點抑制治療時,抑制IL-6和免疫檢查點的聯合治療應更有效。另外,在除IFN-α/β外還會產生IL-6的免疫佐劑治療中,阻斷IL-6信號被認為比較有效。
論文資訊
題目:IL6 Modulates the Immune Status of the Tumor Microenvironment to Facilitate Metastatic Colonization of Colorectal Cancer Cells
期刊:《Cancer Immunology Research》
DOI:10.1158/2326-6066.CIR-18-0766
文:JST客觀日本編輯部翻譯整理














