日本慶應義塾大學理工學部的古川良明副教授、德田榮一助教(研究當時;現為日本大學藥學部專任講師)及研究生院理工學研究科的安齋樹等人,與同大學藥學部的三澤日出巳教授和自然科學研究機構分子科學研究所的秋山修志教授等聯合研究,就肌萎縮性側索硬化症(ALS)發病關聯的銅/鋅離子結合蛋白SOD1,提出了引起其三級結構異常的新機制。SOD1的編碼基因發生突變後,三級結構異常的SOD1會在運動神經元中積累,從而引發ALS。
雖然尚不清楚SOD1結構發生異常的原因,但本次發現氧化的SOD1在銅/鋅離子解離後,會轉換成有毒異常構造。據報告,很多ALS患者都會出現氧化壓力加劇和金屬離子動態異常的現象,因此本研究對探討與SOD1關聯的ALS發病機理至關重要。
銅鋅超氧化物歧化酶(SOD1)是銅離子和鋅離子絡合金屬蛋白,起著將高反應性活性氧——超氧化物轉換為氧分子和過氧化氫的重要作用。已發現在部分ALS患者體內編碼SOD1的基因發生了突變,錯誤摺疊的SOD1會在脊髓的運動神經中積累。另外,SOD1編碼基因未突變的原因不明散發性ALS患者腦脊髓液中,也檢測出了高毒性的錯誤摺疊SOD1。也就是說,SOD1的三級結構異常(錯誤摺疊)可能與ALS發病有關,雖然一直不清楚其觸發因素。
研究團隊從ALS患者的脊髓及周邊腦脊髓液中,氧化壓力標誌物數值畸高,很多生物分子都易被氧化的情況入手,考慮到SOD1產生的過氧化氫是強氧化劑,研究團隊認為SOD1可能伴著氧化而發生了錯誤摺疊。
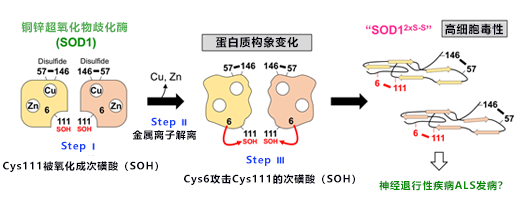
圖1:本次研究提出的SOD1錯誤摺疊新機制
眾所周知,在構成蛋白質的氨基酸中,半胱胺酸(Cys)是最容易被氧化的。SOD1含有4個半胱胺酸。在正常摺疊的SOD1中,其中Cys57和Cys146氧化形成「二硫(S-S)鍵」, 保持空間結構穩定;另外2個半胱胺酸(Cys6和Cys111)一般不會被氧化。但本研究發現,ALS患者的SOD1在產生的過氧化氫作用下,Cys111被氧化成了次磺酸狀態(圖1)。
另外,絡合的銅離子和鋅離子解離後,蛋白質結構發生很大變化。通常位於較遠位置的Cys6會攻擊Cys111轉化的次磺酸,從而在Cys6與Cys111之間也形成S-S鍵(圖1)。
也就是說,隨著氧化壓力的加大和銅、鋅離子解離,會形成含有2個S-S鍵的異常構造SOD1(SOD12xS-S)。該SOD12xS-S容易聚整合不溶性沉澱,當將其添加到運動神經元樣培養模式細胞NSC-34中之後顯示出了毒性,表現出了正常SOD1所不具備的性質。
論文資訊
題目:Oxidative misfolding of Cu/Zn-superoxide dismutase triggered by non-canonical intramolecular disulfide formation
期刊:《Free Radical Biology and Medicine》
DOI:10.1016/j.freeradbiomed.2019.12.017
文:JST客觀日本編輯部編譯














