東京醫科齒科大學難治疾患研究所的東島佳毅研究員和東京大學同位素綜合中心的神吉康晴助教等人,與東京大學醫學部附屬醫院腎臟及內分泌内科和加利福尼亞大學聖地亞哥分校的研究團隊等合作,查清了動脈硬化的表觀遺傳轉錄抑制系統失效及伴生的炎性基因激活的機制。該成果表明,此前已知的動脈硬化中血管內皮細胞發生發炎反應的現象,是由抑制性組蛋白修飾的去甲基化誘發的。
體外細胞培養和小鼠實驗顯示,從遺傳學及藥理學上抑制該機制的靶分子Lysine demethylase 7A(KDM7A)和6A(UTX)後,能改善動脈硬化。動脈硬化是發達國家主要死亡原因——心血管疾病的重要病因。該研究成果有助於開發新的動脈硬化療法及改善心血管疾病患者的預後,這是一項劃時代的成果。
<研究内容>
研究團隊在炎性細胞介素作用於人血管內皮細胞後,利用染色質免疫共沉澱測序(ChIP-seq)全面解析了組蛋白修飾狀態。團隊發現大量對動脈硬化至關重要的炎性基因位點中,抑制性組蛋白修飾H3K9me2及H3K27me3受到刺激後會迅速去甲基化。通過基因篩選確認,Lysine demethylase 7A(KDM7A)和6A(UTX)與這些抑制性組蛋白修飾的去甲基化有關。
進一步詳細研究發現,KDM7A和UTX結合的基因體區域與名為「超級增味劑」的強增味劑相關。通過解析染色體結構確認,這些超級增味劑的相輔作用對炎性基因的轉錄激活非常重要。此外在小鼠模型中確認,使用KDM7A及UTX抑制劑能抑制動脈硬化初期病竈中常見的白血球粘附於血管內皮細胞上的現象。以上結果表明,基於KDM7A和UTX的抑制性組蛋白去甲基化對誘導血管內皮細胞中的炎性基因表現可能非常重要(圖1)。
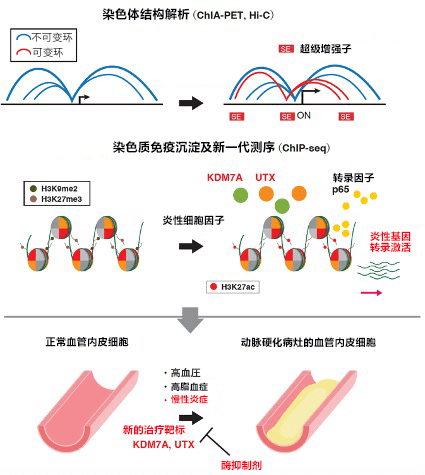
圖1:動脈硬化的血管內皮細胞中,抑制性組蛋白修飾的去甲基化引起的超級增味劑之間的相輔作用(可變環)對炎性基因的轉錄激活至關重要。確定KDM7A及UTX為預防和治療動脈硬化的新靶標。
論文資訊
題目:Coordinated demethylation of H3K9 and H3K27 is required for rapid inflammatory responses of endothelial cells
期刊:《The EMBO Journal》
DOI:10.15252/embj.2019103949
文:JST客觀日本編輯部編譯














