日本京都工藝纖維大學分子化學系的北所健悟副教授等人組成的研究團隊,通過與大阪府立大學綜合復健學研究科的神谷重樹教授、京都大學醫學研究支援中心的奧野友紀子特定講師、理化學研究所放射光科學研究中心利用系統開發研究部門的引間孝明研究員及山本雅貴部門主任等開展聯合研究,利用X射線結構解析法,全球首次查清了金黃色葡萄球菌產生的毒性因子之一「脂肪酶(SAL)」的空間結構。
另外研究團隊還發現,作為抗肥胖藥物銷售的人類脂肪酶抑制劑「奧利司他」與現有的SAL抑制劑相比,抑制SAL活性的效果達到200倍以上。此外,通過在原子水平解析SAL與奧利司他的復合體的結構,成功查清了奧利司他的抑制機制。
這項研究成果有助於推進基於結構資訊的SAL藥物的理論開發,有望實現效果更高、副作用更少的治療藥物的探索和設計。特別是,SAL與金黃色葡萄球菌的增殖有關,因此還有望開發出針對現有抗菌藥無效的MRSA傳染病以及金黃色葡萄球菌引起的特應性皮膚炎等的治療藥物。
研究背景
全球的醫院中都存在現有抗菌藥無效的細菌「超級細菌」,其流行令人擔心。MRSA(耐甲氧西林金黃色葡萄球菌)就是超級細菌的代表,由於其對各種抗菌藥都表現出抗藥性,名為MRSA感染的院内感染已成為嚴重問題。金黃色葡萄球菌(Staphylococcus aureus:以下簡稱SA菌)是化膿的傷口和皮膚表面存在的常居菌,會通過傷口進入體內,並產生大量毒力因子,引起各種疾病。研究發現,在有多種細菌存在的皮膚表面,SA菌異常增加會引起特應性皮膚炎。SA菌產生的毒力因子之一「脂肪酶(SAL)」與SA菌的增殖有關,通過分解具有源自免疫反應的殺菌效果的脂質,提高細菌的存活率,會破壞生物防禦。因此,不僅是抗MRSA藥物的靶標,SAL抑制劑作為治療特應性皮膚炎的藥物也備受關注。
為推進效果更高、副作用更少的新藥探索和設計,此次研究試著運用此前利用大型同步輻射設施「SPring-8」的強同步輻射實施X射線結構解析的經驗,調查了SAL的空間結構。
研究内容
剛開始研究時沒有任何關於SAL空間結構的資訊。另外,針對SAL的抑制劑也沒有活性較強的有效產品。因此,研究團隊首先探索了SAL抑制劑,發現作為抗肥胖藥物已在海外獲批的奧利司他(圖a)能以2.4μM的IC50值抑制SAL。另外發現,奧利司他的抑制活性達到此前已知的SAL抑制劑法尼醇的200倍以上。
在此次研究中,為利用X射線晶體結構解析法在原子水平查清奧利司他分子與SAL結合形成的復合體的空間結構,研究團隊首先利用大腸桿菌構建了SAL的量產體系。純化高純度SAL,製作了SAL單體的晶體與奧利司他共結晶的晶體。X射線繞射實驗和數據收集利用大型同步輻射設施「SPring-8」的光束線BL41XU及BL44XU實施。
SAL的空間結構是與現有的其他細菌的脂肪酶非常相似的三維結構,呈開放式構形,具有覆蓋活性位作用的Lid結構域為開放狀態(圖b)。研究發現,奧利司他分子作為「鑰匙」分子,與SAL的活性位「鑰匙孔」完全嵌合(圖c)。
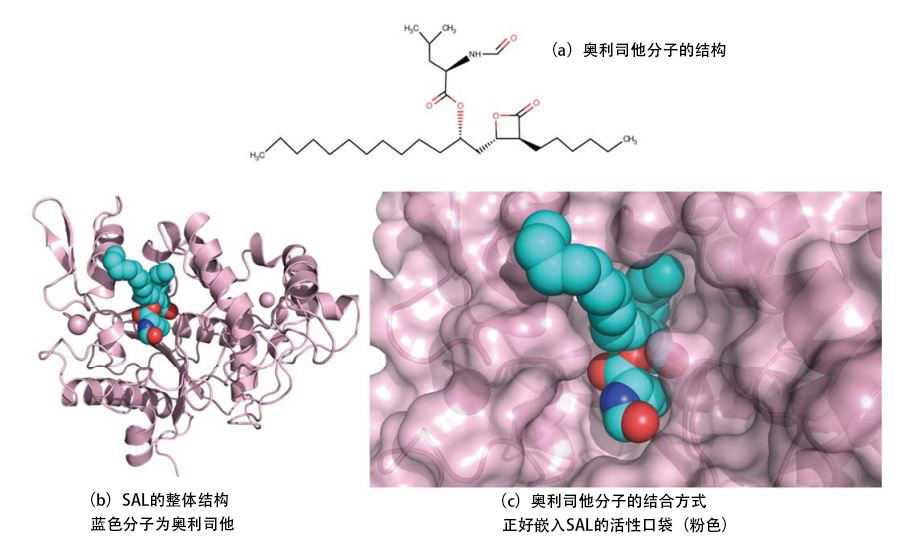
另外,奧利司他是相對比較大的分子,與SAL的催化殘基——第116個絲胺酸殘基的氧原子共價鍵合。其他兩個部分以疎水性相輔作用的形式存在於SAL相對較寬大的活性位——口袋裏。這些結合方式表明,奧利司他對SAL具有較高的選擇性親和性。通過此次的成果,確立了通過藥物設計推進藥物開發的基礎知識。
社會意義與未來展望
研究團隊通過奧利司他與SAL的相輔作用,構建了進行藥物設計的結構基礎。已知MRSA對大多數抗菌藥都產生了抗藥性,會造成新生兒和老人等免疫力較差的患者死亡。
探索針對MRSA的非抗菌藥物非常重要,SAL抑制劑作為針對MRSA感染的具有新作用機制的藥物備受期待。此次的研究結果有望以SAL為靶標,針對MRSA和皮膚病等疾病,開發基於其結構資訊的新藥(Structure based drug design)。另外,奧利司他在海外已經通過審批,因此作為藥物重定位,藥物適用範圍有望擴大到感染症領域。
論文資訊
題目:Crystal structure of pathogenic Staphylococcus aureus lipase complex with the anti-obesity drug orlistat
期刊:《Scientific Reports》
DOI:10.1038/s41598-020-62427-8
文:JST客觀日本編輯部














