日本九州大學生體防禦醫學研究所的中山敬一主任教授和醫學系學府博士課程4年級的小玉學研究生,與新潟大學研究生院醫齒學綜合研究科的松本雅記教授等人組成的研究團隊,通過採用新一代蛋白質組學技術iMPAQT系統的癌症代謝解析發現,在惡性癌症中,利用來自麩醯胺的氮,進行DNA合成的代謝系統亢進(氮轉移)。
碳和氮是生物體的主要構成要素,主要由葡萄糖和麩醯胺兩大營養素提供。大約100年前就已經知道,在癌細胞中,厭氧代謝碳源——葡萄糖的「瓦氏效應」會增強(碳轉移)。另一方面,由於癌細胞活躍增殖,需要大量產生含氮DNA,但此前一直不清楚癌細胞是如何從麩醯胺向DNA高效分配氮的。
為此研究團隊利用自主開發的iMPAQT系統,追蹤了代謝酶的表達隨著癌細胞惡化而發生的變化,發現惡化的癌細胞中高度表達一種將麩醯胺的氮轉移至DNA前驅體的代謝酶PPAT,由此判定引起麩醯胺氮代謝轉移是癌症惡化所必須的步驟。另外,通過對錄入公共數據庫中的11,000名癌症患者進行元分析(meta-analysis),發現PPAT在全部約1200種人代謝酶中是最能提高癌症患者死亡風險的因子,有望作為治療小細胞肺癌等難治性癌症的靶標。這些成果表明,對於目前難以治療的小細胞肺癌等難治性癌症,PPAT抑制劑(目前正在開發中)有望成為有效的治療方法。
<研究背景與經過>
碳和氮是生物體的主要構成要素(圖1)。細胞會吸收葡萄糖(碳源)和麩醯胺(氮源)作為必須的營養素。尤其是癌細胞,大約100年前就已經知道,癌細胞對作為碳源的葡萄糖的厭氧性代謝顯示出強烈的依賴性,這種現象利用發現者的名字命名,稱為瓦氏效應(碳轉移)。另一方面,癌細胞對作為氮源的麩醯胺也顯示出非常強烈的依賴性,但長期以來一直不清楚癌細胞是如何代謝並利用麩醯胺的氮的。
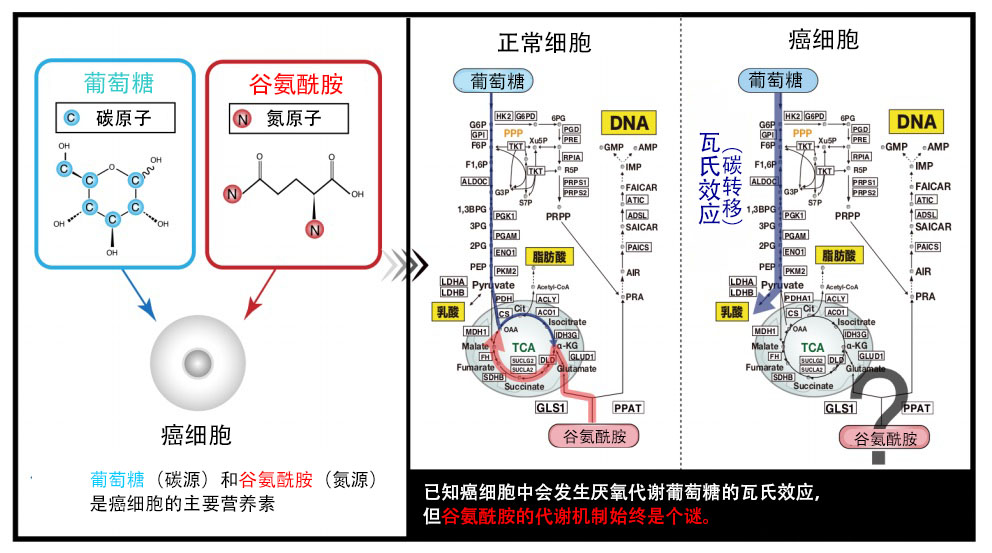
圖1:葡萄糖和麩醯胺是癌細胞不可或缺的營養素
因此,該研究團隊利用自主開發的新一代蛋白質組學技術「iMPAQT系統」,統一測量了癌細胞中表達的所有代謝酶,嘗試調查了癌症惡化過程中麩醯胺的氮代謝機制(圖2)。
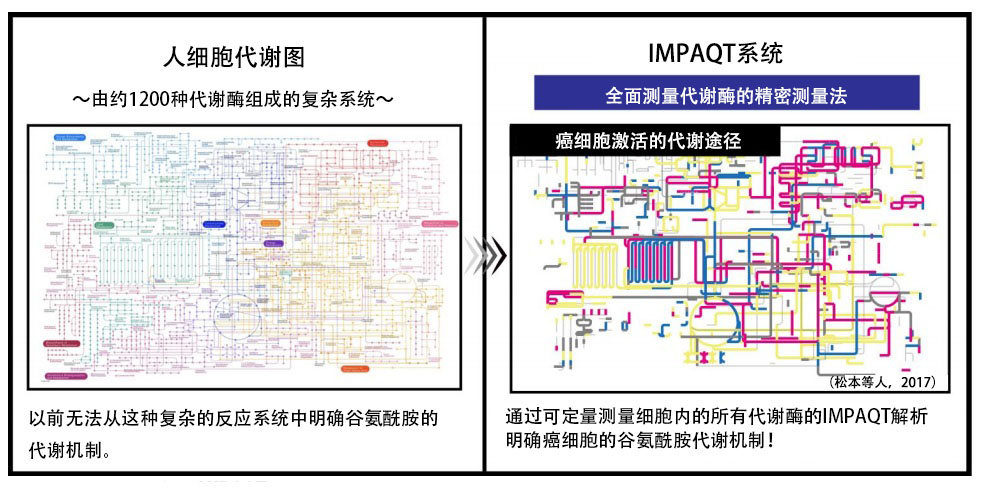
圖2:iMPAQT系統可全面解析癌症代謝酶
<研究内容>
該研究團隊利用iMPAQT系統,比較解析了癌變初期階段的前癌細胞和惡化的癌細胞中的代謝酶表達量(圖3)。解析發現,在惡化的癌細胞中,糖酵解代謝酶的表達升高,瓦氏效應(碳轉移)增強。
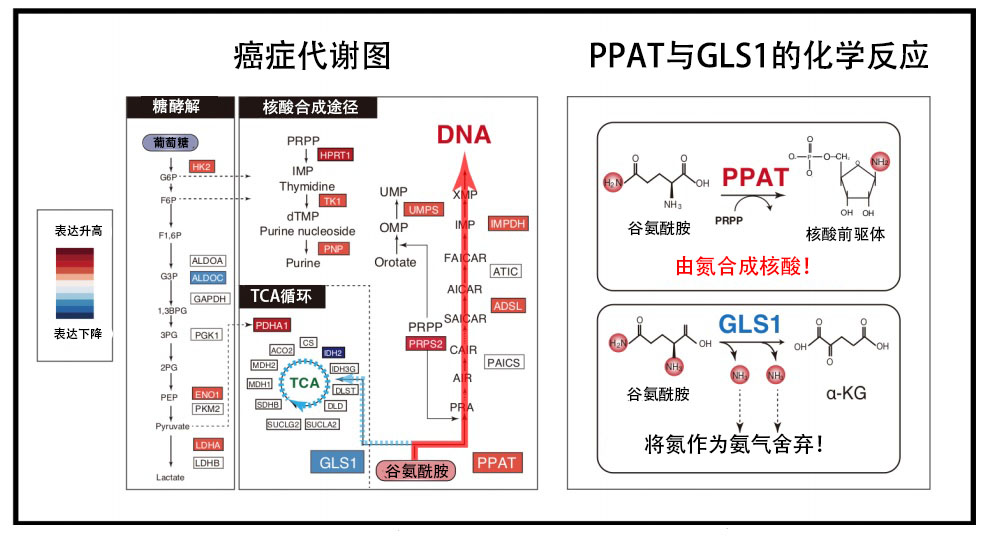
圖3:癌症惡化過程中發生麩醯胺氮代謝轉移
此外,在惡化的癌細胞中,合成DNA的代謝酶群表達升高,其中,將麩醯胺的氮轉移至核酸前驅體的代謝酶PPAT的表達量顯著增加。
相反,負責將麩醯胺的氮作為氨排放到體外的代謝酶麩醯胺酶(GLS1)的表達量明顯下降。這些結果表明,惡化的癌細胞中發生了大規模的氮代謝轉移,也就是說,為有效合成增殖所需的DNA,會增強通過PPAT將麩醯胺氮轉移至DNA前驅體的反應,同時會抑制將麩醯胺的氮排放到體外、而非加以利用的GLS1反應(圖3)。
接下來,為驗證惡化癌細胞中的麩醯胺氮代謝轉移是否是反映在實際癌症患者的預後中的普遍現象,實施了對公共數據庫中錄入的11000名癌症患者數據進行綜合分析的元分析(meta-analysis,圖4)。結果顯示,PPAT是大約1200種代謝酶中最能提高癌症患者死亡風險的因子。相反,屬於GLS1介導的麩醯胺代謝途徑的所有代謝酶都是降低死亡風險的因子(圖4)。這個結果表明,麩醯胺的氮代謝轉移是癌症惡化所必須的步驟,而且是普遍現象。
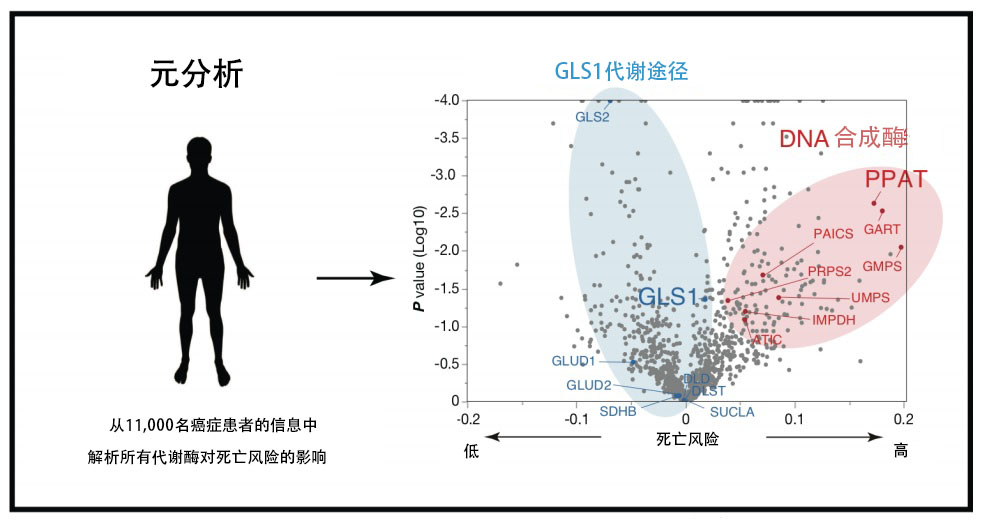
圖4:PPAT會提高癌症患者的死亡風險
這種傾向在尚未確立有效療法的難治性癌症「小細胞肺癌」中最明顯。也就是說,在小細胞肺癌患者體內,癌變部位的PPAT表達量比正常組織明顯升高(圖5)。另外還確認,在小細胞肺癌患者體內,癌變部位的PPAT表達量越高,死亡風險越高(圖5)。
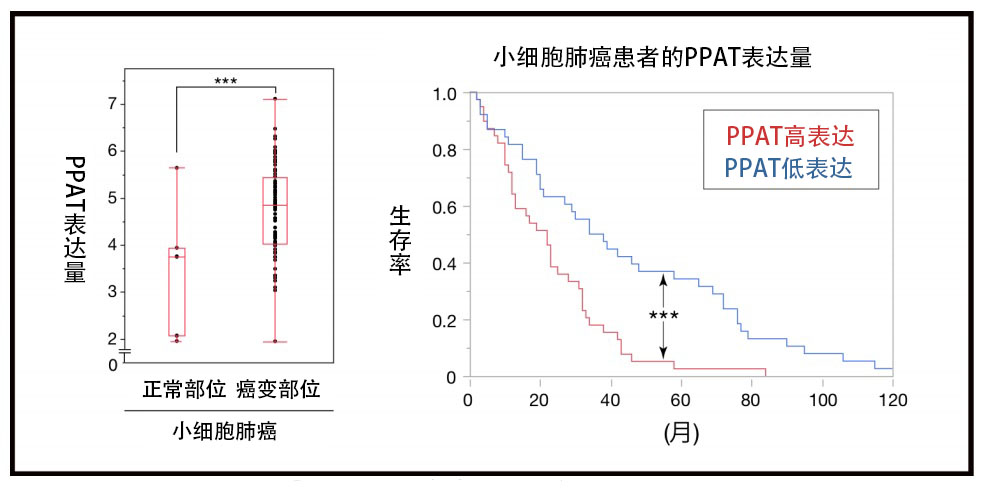
圖5:PPAT將成為小細胞肺癌的新治療靶標
因此,研究團隊人為降低了以小細胞肺癌為首的多種癌症的PPAT表達量,發現麩醯胺的氮代謝轉移被抑制,可以明顯抑制這些癌細胞的增殖能力和致瘤性(圖6)。從這些結果來看,將來通過使用PPAT抑制劑(目前正在開發中)抑制麩醯胺的氮代謝轉移,能有效治療難治性癌症(圖7)。
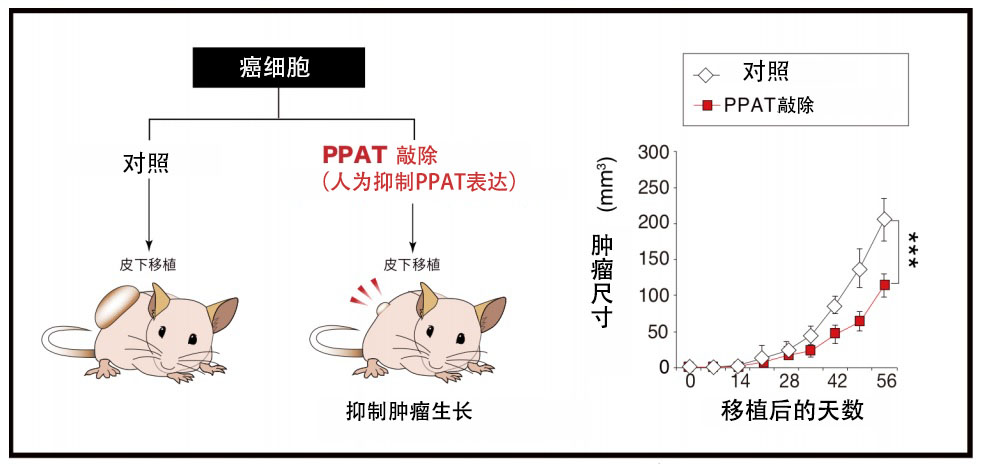
圖6:抑制PPAT的表達可以抑制難治性癌症的生長
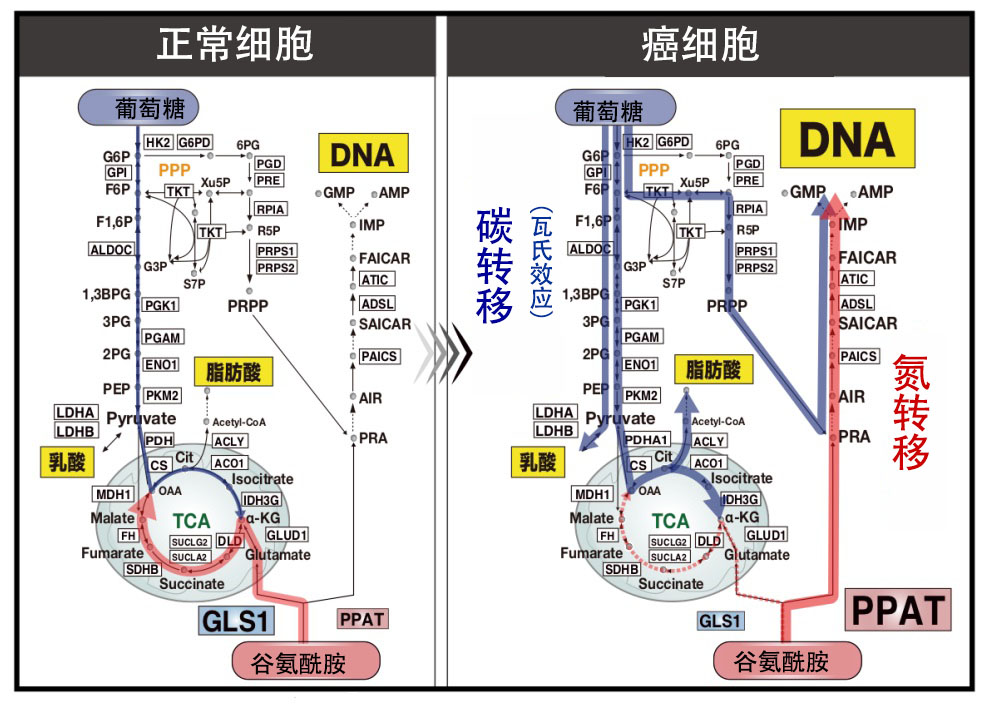
圖7:癌症惡化過程中發生的麩醯胺氮代謝轉移
<未來展望以及用於治療的期待>
目前,該研究團隊正在大規模探索PPAT抑制劑。隨著今後開發出PPAT抑制劑,有望針對以小細胞肺癌為代表的難治性癌症確立新的治療方法。
論文資訊
論文題目:A shift in glutamine nitrogen metabolism contributes to the malignant progression of Cancer
期刊:《Nature Communications》
文:JST客觀日本編輯部














