日本理化學研究所(簡稱「理研」)生命醫科學研究中心免疫轉印控制研究團隊的Wooseok Seo研究員與谷内一郎組長等人,查清了控制細胞遷移的分泌蛋白「趨化因子」——「CCL5」的表達抑制機制,同時還發現,CCL5的表達量會控制免疫細胞的功能,大大影響癌症免疫反應。
這項研究成果有望通過抑制CCL5的活性為開發新的癌症免疫療法做貢獻。
CCL5通過控制免疫細胞向發炎部位遷移的過程來調整免疫反應。近年來有報告顯示,CCL5還參與了對癌細胞的免疫反應,但完全不清楚CCL5的表達是如何調整的。
此次,國際聯合研究團隊發現,RUNX轉錄因子會抑制CCL5基因的表達。通過詳細調查其分子機制,確定了正調控CCL5基因表現的兩個增味劑。另外,通過利用基因編輯技術培育這兩個增味劑缺損的小鼠並進行解析發現,增味劑缺損小鼠因CCL5的表達量降低,自然殺手細胞(NK細胞)的功能增強,由此促進了癌細胞的排除。這些結果證明了一個新發現,即CCL5通過調控免疫細胞的功能狀態來調整癌症免疫反應。
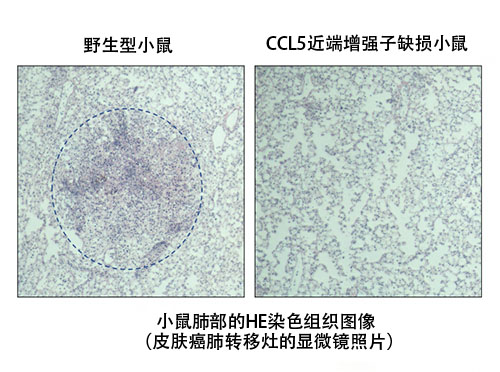
與野生型小鼠相比,CCL5近端增味劑缺損小鼠抑制了癌症轉移竈的形成
研究背景
「趨化因子」是促進細胞遷移(細胞趨化性[Chemotaxis])的分泌蛋白,具有將免疫細胞引導至病原微生物的感染部位並促進免疫反應的作用。趨化因子有很多種類型,「CCL5」是名為CC趨化因子的趨化因子家族的一員,作用於表達其接受者CCR5的細胞。例如,發生發炎時,被激活的殺傷性T細胞和自然殺手細胞(NK細胞)等免疫細胞就會產生CCL5,將表達接受者CCR5的其他免疫細胞引導至發炎部位。
最新研究顯示,趨化因子在針對癌細胞的免疫反應中也發揮著重要作用,CCL5在癌症免疫反應中的功能也受到關注。CCL5的表達量通過調整CCL5基因的表達控制,但此前一直不清楚CCL5基因的表達是如何控制的,尤其是不清楚是否存在抑制CCL5基因表現的機制。
長期研究「RUNX」轉錄因子的功能的谷内一郎組長等人此前報告,RUNX會抑制免疫細胞產生白血球介素-4(IL-4),從而抑制過敏)。此次,國際聯合研究團隊試著探索了通過RUNX抑制產生的分泌蛋白。
研究方法與成果
RUNX轉錄因子可通過識別靶基因周邊存在的調節基因組區域的獨特性DNA序列並與基因體DNA結合,來誘導或抑制靶基因表現。國際聯合研究團隊首先通過基因修飾製作了RUNX轉錄因子功能缺損的小鼠。從該小鼠體內提取殺傷性T細胞進行培養並刺激後,調查了培養液中的分泌蛋白的量,發現與野生型小鼠的殺傷性T細胞相比,RUNX缺損殺傷性T細胞過度表達CC趨化因子家族、尤其是CCL5(圖1)。這表明,CCL5的表達被RUNX抑制。
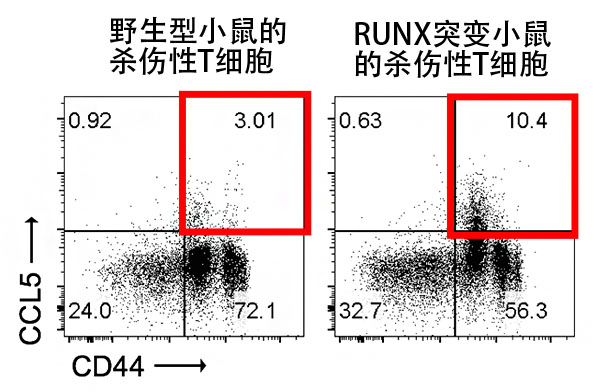
圖1:培養殺傷性T細胞後解析CCL5的表達
與野生型小鼠的殺傷性T細胞相比,RUNX缺損殺傷性T細胞的CCL5表達增強。由此可見,CCL5的表達被RUNX抑制。
為調查RUNX轉錄因子如何抑制CCL5的表達,研究人員利用抗RUNX抗體染色質免疫沉澱法,在CCL5基因周邊探索了RUNX轉錄因子結合的基因體區域。最終在CCL5基因上游5kb(千鹼基=1,000鹼基對)的位置發現了RUNX結合區域,並將該區域命名為「CCL5近端增味劑」。
為調查CCL5近端增味劑的功能,國際聯合研究團隊利用基因編輯技術製作了CCL5近端增味劑缺損的小鼠。CCL5由感染或發炎時被激活的免疫細胞分泌,但在沒有感染或發炎的穩定狀態下,駐留在粘膜等外周組織的組織駐留記憶T細胞也會少量產生CCL5。已知這種穩定狀態下的CCL5表達在維持外周組織中的免疫細胞方面發揮著重要作用。令人喫驚的是,在CCL5近端增味劑缺損小鼠體內,穩定狀態下的CCL5表達消失,但被激活的殺傷性T細胞的CCL5表達未見變化。這個結果表明,其他部位可能也存在誘導CCL5基因在被激活的殺傷性T細胞中表達的增味劑。
因此,國際聯合研究團隊利用最新研究方法(採用名為enChIP的CRISPR/Cas9技術),全面探索了與CCL5基因相輔作用的基因體區域。最終成功確定了在距離CCL5基因1.35Mb(兆鹼基=100萬鹼基對)的極遠端置存在的另一個增味劑區域,並將該區域命名為「CCL5遠端增味劑」。RUNX轉錄因子還與CCL5遠端增味劑結合,在CCL5遠端增味劑缺損的小鼠體內,被激活的殺傷性T細胞的CCL5基因表現消失。
這些結果表明,CCL5基因表現至少受近端增味劑和遠端增味劑這兩種增味劑控制,RUNX轉錄因子拮抗性作用於這兩種增味劑,抑制了CCL5基因的表達(圖2)。此次還是首次確定CCL5基因的增味劑,也是首次確認存在主動抑制CCL5基因表現的機制,可以說是一項劃時代的成果。
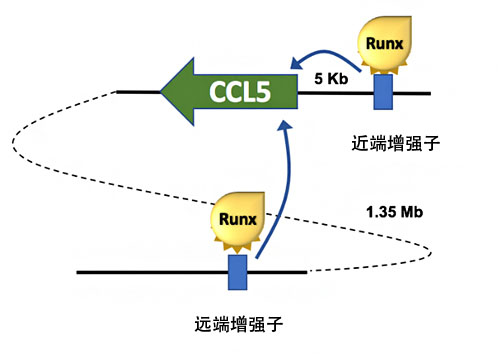
圖2:調整CCL5基因表現的兩種增味劑
CCL5基因5kb上游處存在近端增味劑,1.35Mb遠處存在遠端增味劑,均被RUNX轉錄因子抑制了功能。
近年來的研究成果表明了組織駐留型免疫細胞在癌症免疫反應中的重要性。另外還發現,CCL5對維持組織駐留型免疫細胞至關重要。因此,國際聯合研究團隊利用此次製作的CCL5的兩個增味劑缺損的小鼠和皮膚癌細胞肺轉移模型小鼠,調查了癌症免疫反應。結果顯示,CCL5近端增味劑缺損小鼠抑制了癌細胞肺轉移觀察到的癌細胞轉移竈的形成,也就是說,有效排除了癌細胞(圖3)。
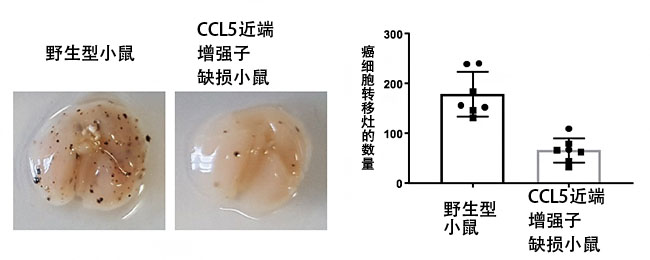
圖3:利用皮膚癌細胞肺轉移模型小鼠的癌症免疫解析結果
左為小鼠肺部照片,黑點表示皮膚癌細胞的肺轉移竈。可以看出,與野生型小鼠相比,CCL5近端增味劑缺損小鼠抑制了癌細胞轉移竈的形成,排除癌細胞的癌症免疫反應增強。
已知在針對皮膚癌細胞肺轉移的癌症免疫反應中,NK細胞發揮著重要作用。因此,國際聯合研究團隊利用名為RNA-seq的研究方法解析了NK細胞的功能。結果發現,因近端增味劑缺損導致肺部的CCL5表達量減少,駐留肺部的NK細胞大量表達了與攻擊癌細胞的功能有關的基因(圖4)。這個結果表明,CCL5除誘導細胞遷移的經典功能外,還具有新功能,可調整正常時駐留組織中的免疫細胞的功能,並調節對癌細胞的免疫反應。研究認為,RUNX轉錄因子通過拮抗性作用於CCL5的增味劑,防止CCL5過度表達來增強癌症免疫反應。
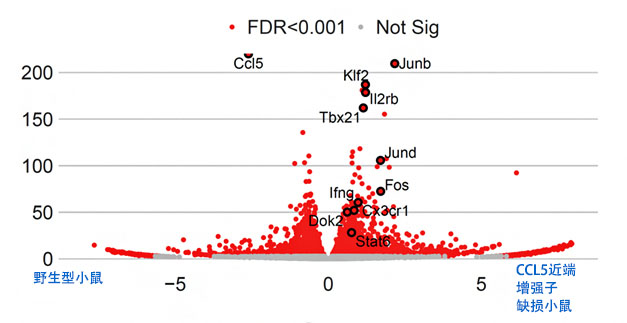
圖4:小鼠肺部駐留的自然殺手細胞的RNA-seq結果
各點表示基因。黑色圓圈圈住的紅點表示野生型和CCL5近端增味劑缺損細胞中表達量不同的基因。CCL5近端增味劑缺損小鼠體內與攻擊癌細胞的功能有關的基因表現量更高。橫軸表示各基因表現量的差異,縱軸表示表達量的顯著差異程度。
未來展望
通過此次研究確認,CCL5是調節免疫細胞功能的重要分子。尤其是隨著CCL5的表達降低,癌症免疫反應會增強,因此通過抑制CCL5及其接受者CCR5,可實現有效的癌症免疫療法,有望應用於新的癌症免疫療法的開發。
論文資訊
題目:Runx-mediated regulation of CCL5 via antagonizing two enhancers influences immune cell function and anti-tumor immunity
期刊:《Nature Communications》
DOI:10.1038/s41467-020-15375-w
文:JST客觀日本編輯部














