日本量子科學技術研究開發機構的平野俊夫理事長與北海道大學遺傳病控制研究所的村上正晃教授共同指出,感染新型冠狀病毒(COVID-19)後出現的急性呼吸窘迫症候群(ARDS: Acute Respiratory Distress Syndrome)實為細胞介素風暴引起的細胞介素釋放症候群(CRS: Cytokine Release Syndrome),IL-6-STAT3通路可作為預防這種症候群的治療靶標。
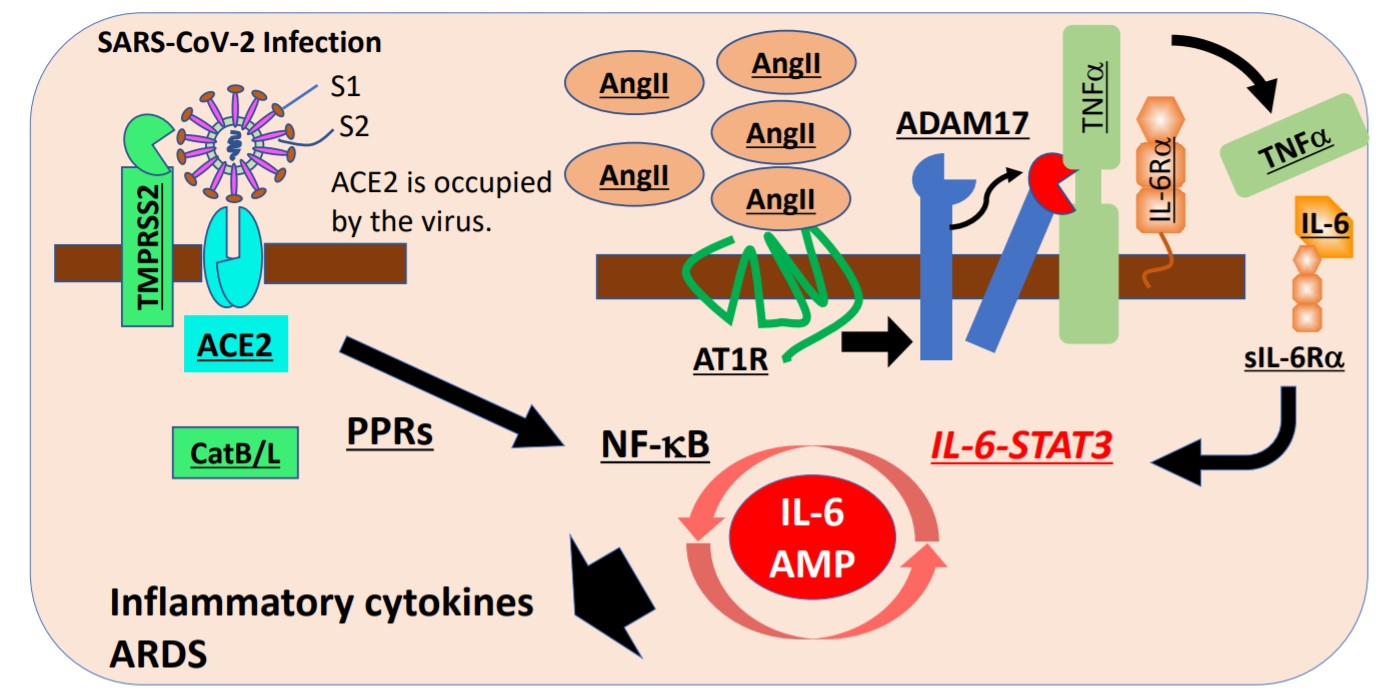
感染SARS-CoV-2時,支氣管和肺泡上皮細胞中的IL-6增幅器(IL-6 Amplifier)被激活,誘發細胞介素過度產生並出現急性呼吸窘迫症候群(ARDS)的模式圖
在支氣管和氣道上皮細胞中與ACE2結合的SARS-CoV-2病毒會在TMPRSS2的作用下進入細胞内。然後激活識別病毒分子結構的細胞圖形辨識接受者(PPRs),進而激活下游的NF-kB通路。另外,隨著病毒的感染,原本與ACE2結合併被分解的血管收縮素(AngII)在血液中增加,來自血管收縮素接受者1(AT1R)的信號變得過剩。
被激活的AT1R信號會激活蛋白質分解酶ADAM17,將細胞膜形態的TNFa、IL-6Ra和成長因子等發炎相關分子變成可溶性分子。可溶性TNFa和IL-6-可溶性IL-6Ra(sIL-6Ra)在包括支氣管和肺泡上皮細胞及血管內皮細胞的非免疫系統細胞中會同時激活NF-kB和STAT3,從而激活過度的NF-kB活性化機構IL-6增幅器,導致這些細胞局部產生過剩的細胞介素。由此引起細胞介素釋放症候群CRS,最終引發COVID-19出現的致命性急性呼吸窘迫症候群ARDS。
COVID-19患者出現的致命性急性呼吸窘迫症候群ARDS屬於細胞介素釋放症候群CRS,如果能治療CRS,新型冠狀病毒將變得不再可怕。有望用來開發治療藥物的靶標包括TMPRSS2、ACE2、AT1R、ADAM17、TNFa以及在IL-6增幅器中發揮重要作用的IL-6-STAT3通路等。尤其是在感染後期出現的致命性ARDS的治療,還有望利用已用於CAR-T治療中的CRS治療,而且可抑制IL-6增幅器的抗IL-6接受者抗體。
論文資訊
COVID-19: a new virus, but an old cytokine release syndrome
(https://marlin-prod.literatumonline.com/pb-assets/products/coronavirus/immuni4349_S5.pdf)
文:JST客觀日本編輯部














