日本金澤大學奈米生命科學研究所及癌症進展控制研究所的中山瑞穗助教和大島正伸教授,與首爾大學的Seong-Jin Kim教授組成的聯合研究團隊,成功查清了p53基因的獨特性突變模式促進大腸癌肝轉移的機制。
抑制癌細胞增殖的p53基因被認為是重要的「抑瘤基因」,在很多癌症中都發現該基因發生了突變,其功能缺損會促進癌變。另一方面,還有報告顯示,通過氨基酸突變獲得新功能的突變型p53會積極促進癌變。這種突變被稱為功能獲得(Gain-of-Function:GOF)型突變。研究團隊開發出了通過移植源自小鼠大腸癌的類器官來再現人類大腸癌肝轉移的模型,發現同時發生p53功能缺損和GOF型突變會誘導轉移竈的形成。
【研究背景】
癌症被稱為基因病,是由基因突變的積累引起的。其中,抑制癌細胞增殖的p53基因在很多癌症中都發生了突變,是重要的「抑瘤基因」。另一方面,已知胺基酸序列隨著基因突變而發生變化的突變型p53會獲得新的促癌功能,被稱為功能獲得(Gain-of-Function:GOF)型突變。不過,關於p53原本具備的抑癌功能的缺損與發生GOF型突變的p53的作用是如何相互關聯並促進癌變和病情惡化的,此前並沒有相關報告。人類一直未能開發出再現體內癌細胞惡化情況的模型被認為是研究沒有取得進展的主要原因之一。
【研究成果概要】
此次,研究團隊此前在小鼠腸道上皮細胞中導入了會引發大腸癌的4種重要基因突變,培養了具備轉移能力的類器官。構成類器官的癌細胞在等位基因染色體單側的p53基因中導入了GOF突變,另一側則保留了野生型p53基因。通過將類器官移植到小鼠身上並解析形成的肝轉移竈發現,缺少野生型p53基因的癌細胞會選擇性地轉移複發(圖1)。
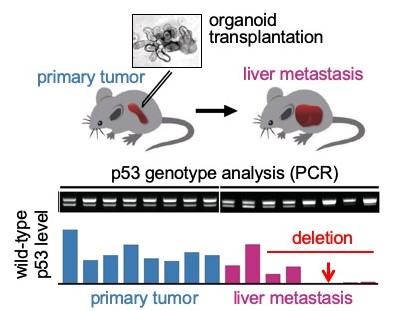
圖1:轉移到肝臟的癌細胞的基因分析結果
將源自大腸癌的類器官移植到小鼠的脾臟中(上),對轉移到肝臟的癌細胞的p53基因狀態實施了PCR解析。結果顯示,轉移的癌細胞大部分都缺少野生型p53(下)。
另外,研究團隊解析類器官發現,表達GOF型突變p53且缺少野生型p53基因的癌細胞,類器官的結構顯著發生變化,在轉移組織中的存活率明顯提高,這種現象被認為會促進轉移竈的形成。此外,基因表現解析顯示,上述獨特性p53突變模式可能會誘導與幹細胞特性及發炎和增殖有關的信號增強,從而促進癌細胞轉移(圖2)。
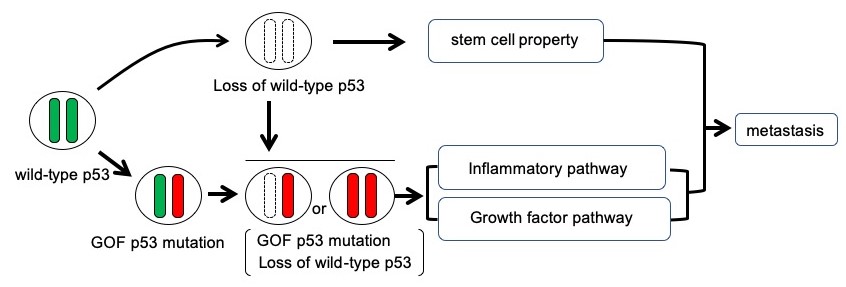
圖2:p53突變模式與癌細胞轉移的關係
缺少野生型p53且p53發生GOF型突變被認為會誘導與幹細胞特性的獲得及發炎和增殖有關的信號增強,從而促進癌細胞轉移。
不僅是大腸癌,很多癌組織中都檢測出p53發生GOF型突變,惡性化的癌細胞中缺少野生型p53。這些現象被認為與癌症的惡性化有關,本研究首次確認,這些現象的相輔作用是促進癌細胞轉移的關鍵。
【未來展望】
上述發現表明,通過壓制性突變型p53的功能,也許能抑制癌細胞轉移,有望用來開發預防和治療大腸癌轉移的新藥。
論文資訊
題目:Loss of wild-type p53 promotes mutant p53-driven metastasis through acquisition of survival and tumor-initiating properties
期刊:《Nature Communications》
DOI:10.1038/s41467-020-16245-1
文:JST客觀日本編輯部














