東京大學研究生院藥學系研究科的富田泰輔教授、堀由螺絲起子講師和邱詠玟研究生等人,與新潟大學腦研究所的池内健教授等人組成的研究團隊,在利用創新技術調查腦功能網路全貌項目「阿茲海默症的Aβ誘導性tau凝集病態傳播與神經廻路變化機制調查」(JP20dm0207073)的支援下,通過採用CRISPR/Cas9系統的全基因體篩檢,查出了與產生Aβ有關的新分子,並由此確定鈣整合素結合蛋白1(Calcium and Integrin-Binding Protein 1:CIB1)是對Aβ的產生有負調控作用的新分子,同時還明確了調控Aβ的機制(圖1)。另外研究團隊還發現,早期阿茲海默症(AD)患者死亡後大腦中的CIB1表達量出現了下降。
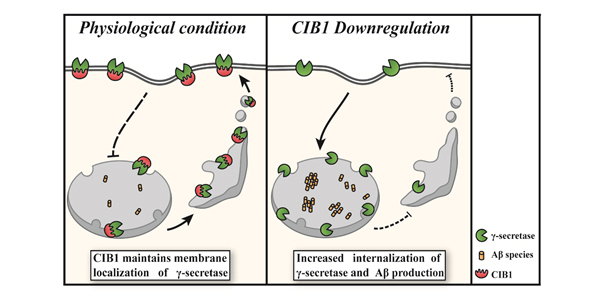
圖1:CIB1調控Aβ產生的機制
研究發現,CIB1將γ分泌酶留在了細胞表面膜上(左圖)。在以往的研究中人們已經知道,γ分泌酶的亞細胞定位會影響其裂解活性。也就是說,CIB1的表達量減少時,細胞表面上的γ分泌酶表達量會下降,Aβ就會出現增加(右圖)。
在當今的老齡化社會,佔老年癡呆症大部分病例的阿茲海默症(AD)已成為嚴重的社會問題,但目前尚未完全明確其發病機理,也沒有確立根治方法。AD早期表現出的病理學特徵是,β-澱粉樣蛋白肽(Aβ)在大腦中的聚集和積累。此前實施的大量遺傳學研究表明,Aβ的聚集和積累會在神經細胞内引起tau的聚集和積累,從而引起神經變性。因此,瞭解Aβ的具體產生機制被認為有助於查清AD發病的早期過程。
Aβ是澱粉樣前驅物蛋白(APP)被β分泌酶和γ分泌酶分兩階段裂解而產生的。其中γ分泌酶的裂解根據其裂解位點的不同會為Aβ的C末端帶來多樣性,並參與跟AD發病有關的高聚集性Aβ分子的產生,因此γ分泌酶的活性調控被認為是治療AD的重要靶標。不過,關於其裂解調控機制一直存在很多不明之處。
此次研究團隊為確定與Aβ產生有關的新分子,利用近年來開發的基因編輯技術CRISPR/Cas9系統,實施了全基因體篩檢。由此成功確定鈣整合素結合蛋白1(Calcium and Integrin-Binding Protein 1:CIB1)是對Aβ產生有負調控作用的新分子。敲低或敲除CIB1減少蛋白質含量,Aβ的產生量出現了增加。
關於其機制,研究團隊通過免疫共沉澱實驗發現CIB1與γ分泌酶存在相輔作用。另外還發現,CIB1不會影響γ分泌酶的總量,但會影響γ分泌酶在細胞表面膜的存在量。這表明,CIB1在生理條件下會與γ分泌酶相輔作用,將γ分泌酶留在細胞膜上(圖1左)。另一方面,研究認為,當CIB1的表達量減少時,這個功能會消失,γ分泌酶的內化增強(圖1右)。此前的研究發現,γ分泌酶的亞細胞定位會影響其裂解活性。也就是說,CIB1通過改變γ分泌酶的亞細胞定位來調控Aβ的產生。
為研究CIB1在AD發病過程中的作用,研究團隊解析了人類AD患者死亡後的腦樣本單細胞RNA測序數據。解析結果發現,在早期AD階段的神經細胞中,CIB1的表達量減少。這些結果表明,神經細胞中的CIB1表達量減少可能會增加Aβ的產生量,並加速AD的發病進程。
此次研究成功確定了與Aβ產生有關的新分子,並明確了部分產生調控機制,是一項極為有意義的成果。另外研究還發現,在AD發病的早期階段,CIB1的表達變化會改變γ分泌酶的亞細胞定位,增加Aβ的產生,從而加速AD的發病進程。今後有望以CIB1為靶標制定新的AD治療和預防戰略,以及開發早期診斷法。
論文資訊
題目:Identification of calcium and integrin-binding protein 1 as a novel regulator of production of Amyloid β peptide using CRISPR/Cas9-based screening system
期刊:《The FASEB Journal》
DOI:10.1096/fj.201902966RR
文:JST客觀日本編輯部














